Равновесие в растворах с осадком
В насыщенном растворе малорастворимого вещества между твердой фазой и раствором устанавливается динамическое равновесие, которое можно представить уравнением:
CaCO3(т.)  Ca2+ + CO32-
Ca2+ + CO32-
Для этого уравнения, используя закон действия масс, запишем выражение константы равновесия
К = 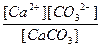
где [Ca2+], [CO32-] - равновесные концентрации ионов в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе), она постоянна.
Умножив К на постоянную величину [CaCO3], получим константу, называемую произведением растворимости, Ksp:.
К×[CaCO3] = Ksp = [Ca2+]× [CO32-]
Произведение растворимости – это произведение концентраций ионов малорастворимого вещества в его насыщенном растворе в степенях их стехиометрических коэффициентов. Числовые значения произведения растворимости малорастворимых веществ представлены в специальных справочных таблицах.
В присутствии одноименных ионов равновесие смещается в сторону образования осадка (эффект одноименного иона). В присутствии сильных электролитов, не содержащих общих ионов, подвижность ионов в растворе уменьшается и равновесие смещается в сторону большего растворения осадка (солевой эффект).
При смешивании растворов, содержащих ионы, дающие нерастворимую соль, начинается выпадение осадка. В первые моменты времени концентрация ионов в растворе велика и осадок выпадает. Постепенно концентрация ионов уменьшается и в растворе устанавливается равновесие.
Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного соединения. Например,
[Ca2+] [CO32-] > Ksp (CaCO3).
Условие растворения осадка: произведение концентраций ионов в растворе (Pi) меньше, чем величина произведения растворимости данного соединения ([Ca2+] [CO32-] < Ksp(CaCO3) ).
Дата добавления: 2016-11-22; просмотров: 2985;
