Электролитическая диссоциация воды
Процесс ионизации воды протекает по уравнению:
Н2О  Н+ + ОН-- + 55,90 кДж/моль.
Н+ + ОН-- + 55,90 кДж/моль.
Константа равновесия процесса диссоциации воды можно записать в виде:
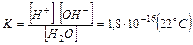
Концентрация молекул воды – постоянная величина, которую можно рассчитать по уравнению:
[H2O]= n(H2O)/1л = 1000  0,9971/18,015 = 55,5 моль/л,
0,9971/18,015 = 55,5 моль/л,
где 0,9971г/мл -плотность воды, 18,015 г/моль -молярная масса воды.
Объединяя две постоянные величины в одной части уравнения, получим:
K[H2O] = 1,8×10-16 × 55,5 = 10-14 = [H+] × [OH-] = KH2O – ионное произведение воды.
Ионное произведение воды увеличивается с увеличением температуры:
| t,°C | ||||
| KH2O | 0,4×10-14 | 1,0×10-14 | 1,9×10-14 | 74×10-14 |
В нейтральном растворе концентрации ионов водорода и гидроксид-ионов равны: [H+] = [OH-] =  = 10-7 моль/л.
= 10-7 моль/л.
В кислом растворе [Н+] > [OH-]; [H+] >10-7 моль/л.
В щелочном растворе [H+] < [OH-]; [H+]< 10-7 моль/л.
Зная концентрацию одного из ионов, например [Н+] и ионное произведение воды, можно рассчитать концентрацию ионов [OH-] и, наоборот.
Пользоваться в расчетах такими малыми величинами концентраций ионов( 10-9, 10-13 моль/л и т.д.) неудобно, поэтому используют их отрицательные десятичные логарифмы. Отрицательный логарифм концентрации ионов водорода (или отрицательный логарифм активности ионов водорода) называют водородным показателем,рН:
рН = –lg[H+]
Зная, что [H+] × [OH-]= 10-14, получим: рН + рОН = 14
В нейтральном растворе при 22оС рН = рОН = 7.
В кислом растворе рН < 7.
В щелочном растворе рН > 7.
Кислотно-основные индикаторы – это вещества, меняющее окраску в определенной области значения ph раствора. Индикаторами могут быть слабые органические кислоты или основания, молекулы и ионы которых имеют разную окраску.
Область перехода окраски некоторых индикаторов
| Индикатор | Цвет | Область перехода окраски, рН | |
| кислотная форма | щелочная форма | ||
| Метилоранж | красный | желтый | 3,2 – 4,5 |
| Фенолфталеин | бесцветный. | красный | 8,2 – 10,0 |
| Лакмус | красный | синий | 6,0 –9,0 |
Буферные растворы
Буферные растворы используют для поддержания постоянной величины рН в исследуемом растворе при добавлении к нему небольших количеств сильной кислоты, сильного основания или при разбавления раствора.
В качестве буферных растворов обычно используют смеси растворов слабых кислот или слабых оснований и их солей или смеси солей многоосновных кислот различной степени замещения. В таблице приведены примеры наиболее часто используемых буферных растворов и величины рН, которые они поддерживают:
| Состав буферного раствора | Название буфера | рН |
| Смесь СН3СООН и СН3СООNа | Ацетатный буфер | 4,7 |
| Смесь NаН2РО4 и Nа2НРО4 | Фосфатный буфер | 6,5 |
| Смесь NН4ОН и NН4С1 | Аммиачный буфер | 9,25 |
Буферная система может связывать как ионы Н+, так и ОН- приливаемых сильных кислот и оснований в слабые электролиты, незначительно изменяя величину рН раствора.
Пример: Ацетатный буферный раствор содержит смесь CH3COOH и CH3COONa. Диссоциация слабого электролита – уксусной кислоты – отражается уравнением реакции: CH3COOH  CH3COO
CH3COO 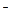 + H+ и описывается константой равновесия:
+ H+ и описывается константой равновесия:
Ka= 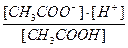 = 1.8 10
= 1.8 10 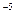
При добавлении ацетата натрия концентрация ионов CH3COO 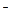 возрастает и определяется концентрацией соли: [CH3COO
возрастает и определяется концентрацией соли: [CH3COO 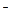 ]
] 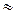 Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH]
Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH] 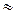 Cк, где Cк – концентрация кислоты.
Cк, где Cк – концентрация кислоты.
Ka=  ;
;
[H+] = Ka 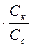 ;
;
pH = –lg[H+] = pKa – lg ( 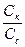 ),
),
где pKa = - lg Ka .
Таким образом, рН буферных растворов не зависит от концентраций компонентов, а определяется их отношением.
При добавлении небольших количеств сильных кислот и оснований компоненты буферного раствора реагируют с ними, переводя их в слабые электролиты:
CH3COOH + NaOH = CH3COONa + H2O (концентрация соли увеличивается на концентрацию добавленной щелочи, а концентрация кислоты уменьшается на ту же величину):
pH = –lg[H+] = pKa - lg ( 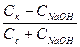 );
);
CH3COONa + HCl = CH3COOH + NaCl,
pH = –lg[H+] = pKa - lg (  ).
).
Так как отношение концентраций изменяется меньше, чем их сумма или разность, общее значение рН изменяется незначительно.
Количество сильной кислоты или сильного основания, которые нужно добавить к буферному раствору для изменения рН одного литра его раствора на единицу, называют буферной емкостью (B). Она может быть вычислена относительно кислоты (Bа) или основания (Bb).
Ba= 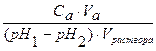
Bb= 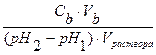
где Ba и Bb – буферные емкости по кислоте и основанию соответственно; Ca и Cb – концентрации добавленных кислоты и основания; pH1 и pH2 – исходные и конечные значения рН раствора; Va and Vb – объемы добавленных сильных кислоты и основания.
Дата добавления: 2016-11-22; просмотров: 1325;
