Типы реакций гидролиза.
1. Соль образована ионами сильного основания и сильной кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
2. Соль образована ионами сильного основания и слабой кислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
CO32  + HOH
+ HOH  HCO3
HCO3  + OH
+ OH (среда щелочная, рН>7).
(среда щелочная, рН>7).
Na2CO3+ HOH  NaHCO3 + NaOH (1 ступень гидролиза).
NaHCO3 + NaOH (1 ступень гидролиза).
Добавление к раствору щелочей (NaOH), содержащих одноименные ионы (OH  ), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH
), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH 
 Н2О, в результате которой концентрация ионов OH
Н2О, в результате которой концентрация ионов OH  в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
НCO3  + HOH
+ HOH  H2CO3 + OH
H2CO3 + OH 
NaНCO3 + HOH  H2CO3 + NaOH (2 ступень гидролиза).
H2CO3 + NaOH (2 ступень гидролиза).
3. Соль образована ионами слабого основания и сильной кислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O  гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
Al3+ + HOH  AlOH2+ + H+ (среда кислая, рН<7)
AlOH2+ + H+ (среда кислая, рН<7)
AlCl3 + HOH  AlOHCl2 + HCl (1 ступень гидролиза).
AlOHCl2 + HCl (1 ступень гидролиза).
4. Соль образована ионами слабого основания и слабой кислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O  гидролиз идет сразу по катиону и аниону:
гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32  + HOH
+ HOH  NH4OH + HCO3
NH4OH + HCO3  + NH4+ (рН
+ NH4+ (рН 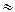 7)
7)
(NH4)2CO3 + HOH  NH4OH + NH4HCO3
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O  нерастворимые соли гидролизу не подвергаются.
нерастворимые соли гидролизу не подвергаются.
в) соль разлагается водой (в таблице растворимости стоит прочерк, например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет необратимо и до конца: Fe2S3+6H2O  2Fe(OH)3
2Fe(OH)3 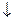 +3H2S
+3H2S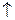
Количественно гидролиз описывается величинами константы гидролиза (Kh) и степени гидролиза (h).
NaCN + H2O  NaOH + HCN
NaOH + HCN 
CN- + H2O  OH- + HCN; pH > 7
OH- + HCN; pH > 7
Константу гидролиза можно выразить через концентрации ионов в растворе с учетом того, что концентрация воды практически не изменяется, или по правилу вычисления константы равновесия обратимой реакции:
K 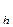 =
= 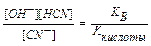
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
NH4+ + H2O  H+ + NH4OH; pH < 7
H+ + NH4OH; pH < 7
Kh = 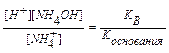
NH4CH3COO + H2O  NH4OH + CH3COOH
NH4OH + CH3COOH
NH4+ + CH3COO  + H2O
+ H2O  NH4OH + CH3COOH
NH4OH + CH3COOH
Kh = 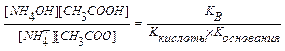
Степень гидролиза “h” определяет ту часть соли, которая подверглась гидролизу при данных условиях: 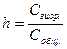 .
.
Степень гидролиза связана с константой гидролиза:
Kh = 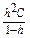 .
.
В том случае, когда h << 1, Kh = h2C.
Пример. Вычисление рН 0,1 М раствора фосфата калия.
Будем считать, что гидролиз протекает в основном по первой ступени:
PO43  + HOH
+ HOH  HPO42
HPO42  + OH
+ OH 
Кг = 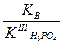 =
= 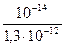 = 7,69 10
= 7,69 10  3
3
h = 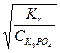 =
= 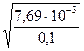 =
= 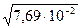 = 2,77 10
= 2,77 10  1
1
[OH  ] = hC = 2,77 10
] = hC = 2,77 10  1 * 0,1 = 2,77 10
1 * 0,1 = 2,77 10  2;
2;
[H+] = 10  14 / [OH
14 / [OH  ] = 10
] = 10  14 / 2,77 10
14 / 2,77 10  2 = 3,61 10
2 = 3,61 10  13;
13;
рН= -lg[H+] = 12,44.
Дата добавления: 2016-11-22; просмотров: 1346;
