Смещение равновесия реакции гидролиза
Если в раствор гидролизующейся соли ввести реактив, связывающий образующиеся при гидролизе ионы Н+ или ОН  , то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью - до образования конечных продуктов. Например, добавление к раствору карбоната натрия небольшого количества сильной кислоты приведет к усилению гидролиза за счет связывания образующихся в процессе гидролиза ионов ОН
, то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью - до образования конечных продуктов. Например, добавление к раствору карбоната натрия небольшого количества сильной кислоты приведет к усилению гидролиза за счет связывания образующихся в процессе гидролиза ионов ОН  :
:
Na2CO3 + H2O  NaHCO3 + NaOH
NaHCO3 + NaOH
CO32  + HOH
+ HOH  HCO3
HCO3  + OH
+ OH 
OH  + H+
+ H+  H2O
H2O
В результате становится возможной и вторая ступень гидролиза карбоната натрия:
NaHCO3 + H2O  H2CO3 + NaOH
H2CO3 + NaOH
HCO3  + HOH
+ HOH  H2CO3 + OH
H2CO3 + OH  .
.
Добавляя к системе избыток одного из образующихся при реакции веществ (кислоты или щелочи), можно подавить гидролиз (сместить равновесие гидролиза в обратную сторону). Так, в случае карбоната натрия растворы щелочей ослабляют или даже полностью прекращают гидролиз соли.
Подкисление или подщелачивание растворов солей часто используют на практике для стабилизации их разбавленных растворов.
Равновесие реакции гидролиза может смещаться в сторону его усиления, если продуктом одной из ступеней гидролиза будет малорастворимое соединение:
Bi(NO3)3 + HOH  BiOH(NO3)2 + HNO3
BiOH(NO3)2 + HNO3
Bi3+ + HOH  BiOH2+ + H+
BiOH2+ + H+
При разбавлении раствора равновесие реакции смещается вправо за счет образования осадка нитрата оксовисмута:
BiOH(NO3)2 + HOH  Bi(OH) 2NO3 + HNO3
Bi(OH) 2NO3 + HNO3
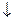
BiONO3 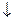 + H2O
+ H2O
BiOH2+ + HOH + NO3 
 BiONO3 + H+
BiONO3 + H+
Аналогично протекает гидролиз хлорида сурьмы (III).
Гидролиз соли можно усилить также нагревая или разбавляя ее раствор.
Взаимный гидролиз
Ионы Н+ (или ОН  ) можно связать в молекулы воды, вводя в раствор не только щелочь (или кислоту), но и другую соль, гидролиз которой приводит к накоплению в растворе ионов ОН
) можно связать в молекулы воды, вводя в раствор не только щелочь (или кислоту), но и другую соль, гидролиз которой приводит к накоплению в растворе ионов ОН  (или Н+); ионы Н+ и ОН
(или Н+); ионы Н+ и ОН  будут нейтрализовать друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате - образование конечных продуктов гидролиза (взаимный гидролиз). Например, при смешивании растворов Na2CO3 и AlCl3 , в которых соответственно имеется избыток ионов ОН
будут нейтрализовать друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате - образование конечных продуктов гидролиза (взаимный гидролиз). Например, при смешивании растворов Na2CO3 и AlCl3 , в которых соответственно имеется избыток ионов ОН  и Н+ соответственно, взаимное усиление гидролиза приводит к выделению СО2 и образованию осадка Al(OH)3 :
и Н+ соответственно, взаимное усиление гидролиза приводит к выделению СО2 и образованию осадка Al(OH)3 :
2AlCl3 + 3Na2CO3 + 3H2O  2Al(OH)3
2Al(OH)3 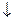 + 3CO2
+ 3CO2 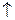 + 6NaCl
+ 6NaCl
2Al3+ + 3CO32  + 3H2O
+ 3H2O  2Al(OH)3
2Al(OH)3 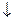 + 3CO2
+ 3CO2 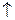
В осадок в подобных случаях выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость карбоната гидроксомеди (CuOH)2CO3 меньше, чем растворимость гидроксида меди Cu(OH)2 . Поэтому при сливании растворов CuSO4 и Na2CO3 конечным продуктом гидролиза является именно (CuOH)2CO3 :
2CuSO4 + 2Na2CO3 + H2O  (CuOH)2CO3
(CuOH)2CO3 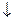 + CO2
+ CO2 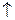 + 2Na2SO4
+ 2Na2SO4
2Cu2+ + 2CO32  + H2O
+ H2O  (CuOH)2CO3
(CuOH)2CO3  + CO2
+ CO2 
Взаимный гидролиз - необратимый процесс.
Дата добавления: 2016-11-22; просмотров: 4308;
