Примеры решения задач
Пример 32. Запишите уравнения реакций гидролиза следующих солей и определите реакцию среды (нейтральная, кислая, щелочная): a)FeCl2; б)Na2CO3; в) KCl; г) Fe2S3.
Решение.
а) Запишем уравнение диссоциации соли и определим силу кислоты и основания, образующих данную соль:
FeCl2  Fe2+ + 2Cl-
Fe2+ + 2Cl-
Соль образована слабым основанием Fe(OH)2 и сильной кислотой HCl. В гидролизе участвует ион слабого основания, гидролиз идет по катиону:
Fe2+ + HOH  FeOH+ + H+ (кислая среда рН < 7),
FeOH+ + H+ (кислая среда рН < 7),
Так как ионы Cl- не принимают участия в гидролизе, то они присутствуют в неизменной форме в левой и правой частях уравнения:
Fe2+ + 2Cl- + HOH  FeOH+ + H+ + 2Cl-
FeOH+ + H+ + 2Cl-
Для того, чтобы записать уравнение реакции гидролиза в молекулярной форме, объединим ионы в молекулы в соответствии с их зарядами:
FeCl2 + HOH  FeOHCl + HCl –уравнение реакции гидролиза в молекулярной форме.
FeOHCl + HCl –уравнение реакции гидролиза в молекулярной форме.
б) Na2CO3  2Na+ + CO32-
2Na+ + CO32-
Cоль образована сильным основанием NaOH и слабой кислотой Н2СО3. В гидролизе участвует ион слабой кислоты, гидролиз идет по аниону:
СО32- + НОН  НСО3- + ОН- (щелочная среда рН > 7),
НСО3- + ОН- (щелочная среда рН > 7),
Так как ионы Na+ не принимают участия в гидролизе, то они присутствуют в неизменной форме в левой и правой частях уравнения:
2Na+ + CO32- + HOH  HCO3- + OH- + 2Na+
HCO3- + OH- + 2Na+
Для того, чтобы записать уравнение гидролиза в молекулярной форме, объединим ионы в молекулы в соответствии с из зарядами:
Na2CO3 + HOH  NaHCO3 + NaOH
NaHCO3 + NaOH
в) KCl – эта соль гидролизу не подвергается, т.к. образована сильным основанием – КОН и сильной кислотой HCl. Среда нейтральная, рН = 7.
г) Fe2S3
В таблице растворимости для соли Fe2S3 стоит прочерк, это значит, что гидролиз соли идет необратимо и до конца, до образования соответствующих основания и кислоты:
Fe2S3 + 6H2O = 2Fe(OH)3¯ + 3H2S
Пример 33. Рассчитайте константу гидролиза в растворе хлорида аммония.
Решение.
NH4Cl + H2O  NH4OH + HCl
NH4OH + HCl
NH4+ + H2O  H+ + NH4OH; pH <7
H+ + NH4OH; pH <7
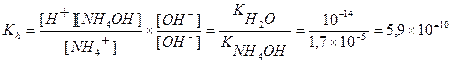
Коллоидные растворы
Коллоидные системы – это ультрамикрогетерогенные системы, состоящие из двух фаз: дисперсионной среды и дисперсной фазы. Дисперсная фаза коллоидных растворов состоит из молекулярных агрегатов размером 10 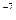 - 10
- 10 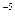 cм.
cм.
Дата добавления: 2016-11-22; просмотров: 862;
