Строение комплексных соединений
Один из атомов комплексного соединения, обычно положительно заряженный катион металла, занимает центральное место в комплексе (центральный ион или ион-комплексообразователь). Нейтральные молекулы или ионы с противоположным зарядом (лиганды) образуют с центральным ионом химические связи по донорно-акцепторному механизму. Центральный ион и лиганды образуют внутреннюю сферу комплексного соединения (комплексный ион), который обычно записывают в квадратных скобках. Химическая связь во внутренней сфере комплексных соединений образуется по донорно-акцепторному механизму с участием пустых орбиталей катиона металла и неподеленных пар электронов атомов лигандов.
Противоположно заряженные ионы, электростатически связанные с комплексным ионом и нейтрализующие его заряд, носят название внешней сферы комплекса. Внешняя и внутренняя сферы комплекса связаны между собой ионной связью.
Общее число химических связей, которые образует с лигандами ион-комплексообразователь, называется координационным числом центрального иона. Координационное число зависит от заряда иона-комплексообразователя (для однозарядных ионов к.ч. = 1, для двухзарядных – 4 или 6, для трехзарядных – 6 и выше), и размера иона (чем больше ион-комплексообразователь, тем выше к.ч., для ионов лантанидов и актинидов к.ч. может доходить до 12).
Число химических связей, образованных одним лигандом с центральным атомом, называется дентатностью лиганда. Выделяют моно-, би- и полидентатные лиганды. Дентатность определяется числом неподеленных пар электронов в молекуле лиганда и их взаимным направлением. Например, молекула аммиака имеет одну пару электронов у атома азота :NH3, поэтому аммиак – монодентатный лиганд. Молекула воды имеет 2 пары электронов, а хлорид-ион – четыре. Однако в связи с тем, что валентные орбитали кислорода и хлора находятся в состоянии sp3-гибридизации и расположены под углом 109°28’, то они не могут образовать связь с одним центральным ионом, поэтому такие лиганды монодентатны. Исключение – полиядерные комплексы, например, Na2[CuCl6]:
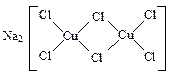
Например, для соединения K3[Fe(CN)6]:
1. Внешнюю сферу составляют ионы 3К+.
2. Внутреннюю сферу (комплексный ион) составляют ионы [Fe(CN)6]3–.
3. Центральный ион (комплексообразователь) – Fe3+.
4. Координационное число комплексообразователя равно 6.
5. Лиганды – CN– анионы, их дентатность равна 1 (монодентатные).
Дата добавления: 2016-11-22; просмотров: 709;
