Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекаетнеобратимо (до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 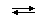 H+ + H2PO4− (α = 23,5%)
H+ + H2PO4− (α = 23,5%)
H2PO4− 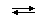 H+ + HPO42− (α = 3 · 10−4%)
H+ + HPO42− (α = 3 · 10−4%)
HPO42− 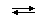 H+ + PO43− (α = 2 · 10−9%)
H+ + PO43− (α = 2 · 10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
Дата добавления: 2016-07-09; просмотров: 1133;
