Равновесия в насыщенных растворах малорастворимых солей. Расчет растворимости малорастворимой соли. Способы увеличения растворимости малорастворимых солей
Константу равновесия в данном случае называют константой диссоциации (константой ионизации). Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора. Константа диссоциации - важная характеристика слабых электролитов. Чем меньше величина Kд , тем слабее диссоциирует электролит в данном растворителе.Кд(приблиз.равна)альфа^2*C или альфа(приблиз.равна)под корнем-Кд/С
б)т.д.
Потенциометрия позволяет определить произведение растворимости малорастворимой соли. Например, для малорастворимой соли АВ в её насыщенном растворе
имеет место равновесие:
АВ(Т)↔А
+ + B–
Произведение активности можно выразить уравнением:
Lа = a+・a– (2)
Для насыщенных растворов малорастворимых солей, не содержащих других
веществ, повышающих ионную силу раствора, произведения активности и раство-
римости совпадают, поэтому для соли АВ можно написать:
L(AB)=aA+*aB-
32. Гидролиз солей, образованных: а)сильным основанием и слабой кислотой, б) слабым основанием и сильной кислотой. Качественная оценка рН растворов гидролизующихся солей.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).Различают обратимый и необратимый гидролиз солей
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):


(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):

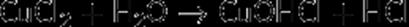
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:


(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
б)Различают 3 случая гидролиза солей:
а) гидролиз соли по аниону ( соль образована слабой кислотой и сильным основанием, например CH3COO Na). Значение рН рассчитывают по формуле (7):
рН = 7 + 1/2 рКк + 1/2 lg Сс ( 7)
б) гидролиз соли по катиону ( соль образована слабым основанием и сильной кислотой, например NH4Cl ).Расчет рН в таком растворе ведут по формуле (8):
рН = 7 - 1/2 рКо - 1/2 lg Сс ( 8)
в) гидролиз соли по катиону и аниону ( соль образована слабой кислотой и слабым основанием, например CH3COO NH4 ). В этом случае расчет рН ведут по формуле (9) :
рН = 7 + 1/2 рКк - 1/2 рКо (9)
Если соль образована слабой многоосновной кислотой или слабым многопротонным основанием , то в перечисленные выше формулы (7-9) расчета рН подставляются значения рКк и рКо по последней ступени диссоциации
Дата добавления: 2016-07-09; просмотров: 1740;
