Реакции самоокисления - самовосстановления (диспропорционирования). Внутримолекулярные окислительно-восстановительные процессы.
Реакции диспропорционирования – ОВ реакции, которые происходит с веществами, содержащими элемента в промежуточных степенях окисления. В таких реакциях один и тот же элемент выступает в качестве и окислителя, и восстановителя. Примерами реакций диспропорционирования являются превращения галогенов и серы в щелочной среде, манганатов – в кислой, хлоратов при нагревании.
Реакции внутримолекулярного окисления-восстановления – реакции веществ, содержащих в своем составе окислитель и восстановитель, для взаимодействия которых требуется активация (часто нагревание).
Например, дихромат аммония при нагревании разлагается (претерпевает внутримолекулярные окисления и восстановления)
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O
37. Уравнение Нернста. Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
Уравнение Нернста – уравнение, позволяющее рассчитать окислительно-восстановительный потенциал для полуреакций в растворах различного состава. (уравнение полуреакций составляется для реакций восстановления окислителя)
Уравнение:
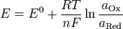 ,
,
где
·  — электродный потенциал,
— электродный потенциал, 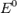 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
· 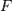 — постоянная Фарадея.
— постоянная Фарадея.
· 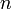 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
· 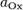 и
и 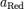 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Уравнение Нернста выводится из уравнения изотермической реакции:
ΔG=-nFΔE˚
Fe+3+eFe+2
EFe+3/Fe+2 = 0, 77 В
EFe+3/Fe+2 = EFe+3/Fe+2 + RT/F ln [Fe+3]/[Fe+2]
Дата добавления: 2016-07-09; просмотров: 1452;
