Физико-химические процессы в растворах
Взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя может состоять из нескольких процессов, протекающих последовательно или одновременно.
1. Молекулярная диссоциация:
(АВ)k  k AB
k AB
2. Взаимодействие с молекулами растворителя с образованием сольватов:
AB + (n+m)S  AB × (n+m)S
AB × (n+m)S
3. Электролитическая диссоциация – распад вещества на ионы:
AB × (n+m)S  Ax+× nS + Bx-× mS
Ax+× nS + Bx-× mS
Если вещество при растворении не подвергается диссоциации, то это неэлектролит. Если вещество в процессе растворения распадается на ионы, то это электролит.
В растворах некоторых электролитов диссоциирует лишь часть молекул (процесс диссоциации обратим). Количественной характеристикой электролитической диссоциации является степень диссоциации:
a = Nдис / Nобщ = Сдис / Собщ,
где N – число молекул; С – концентрация электролита в растворе.
По величине степени диссоциации электролиты делятся на две группы:
Если a > 0,3 (30%), то такие электролиты называют сильными. К сильным электролитам относятся некоторые кислоты (HCl, H2SO4, HNO3, HClO4, HBr, HI), щелочи (растворимые в воде основания металлов, такие как NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.) и практически все соли. В растворах сильные электролиты практически полностью распадаются на ионы (диссоциация сильных электролитов необратимая и одноступенчатая):
Al2(SO4)3 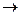 2 Al3+ + 3 SO4
2 Al3+ + 3 SO4 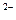
Если степень диссоциации электролита a < 3%, то электролиты называют слабыми. К слабым электролитам относятся молекулы воды, гидроксида аммония NH4OH, слабых кислот и оснований. Диссоциация слабых электролитов - процесс обратимый и ступенчатый, для него устанавливается состояние химического равновесия, которое характеризуется константой равновесия - константой диссоциации.
Например, диссоциация фосфорной кислоты - трехступенчатый процесс:
1 ступень: H3PO4  H+ + H2PO4
H+ + H2PO4 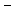 ; K1 =
; K1 = 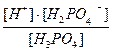 =8×10-3
=8×10-3
2 ступень: H2PO4 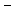
 H+ + HPO4
H+ + HPO4  ; K2 =
; K2 = 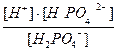 =6×10-8
=6×10-8
 3 ступень: HPO4
3 ступень: HPO4 
 H+ + PO4
H+ + PO4  ; K3 =
; K3 = 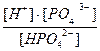 =2×10-12
=2×10-12
Суммарный процесс:
H3PO4  3H+ + PO4
3H+ + PO4  ; K =
; K = 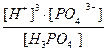 = К1×К2×К3=1×10-21
= К1×К2×К3=1×10-21
[H+], [H2PO4 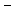 ], [HPO4
], [HPO4  ], [PO4
], [PO4  ], [H3PO4] - равновесные концентрации ионов;
], [H3PO4] - равновесные концентрации ионов;
К1, К2, К3 - ступенчатые константы диссоциации;
К - общая константа диссоциации.
Обменные реакции в растворах происходят между ионами сильных электролитов и молекулами слабых электролитов. Равновесие реакций обмена в растворах смещено в сторону образования осадков, газов, молекул слабых электролитов.
В ионном виде реакции обмена записывают следующим образом:
- сильные растворимые в воде электролиты пишут в виде ионов;
- слабые электролиты, осадки и газы записывают в виде молекул:
2NaNO2 + H2SO4  Na2SO4 + 2HNO2
Na2SO4 + 2HNO2
растворимая сильная растворимая слабая
в воде соль кислота в воде соль кислота
(реакция в молекулярном виде)
2Na+ + 2NO2 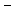 + 2H+ + SO42
+ 2H+ + SO42 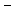
 2Na+ + SO42
2Na+ + SO42 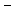 + 2HNO2
+ 2HNO2
(полное ионное уравнение реакции)
2NO2  + 2H+
+ 2H+  2HNO2
2HNO2
(сокращенное ионное уравнение реакции)
Свойства химических соединений в растворах определяются характером их диссоциации:
HCl 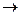 H+ + Cl
H+ + Cl  (кислоты при диссоциации дают ионы Н+);
(кислоты при диссоциации дают ионы Н+);
NaOH 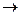 Na+ + OH
Na+ + OH 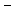 (основания при диссоциации дают ионы ОН-);
(основания при диссоциации дают ионы ОН-);
NaCl 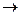 Na+ + Cl
Na+ + Cl 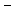 (cоли при диссоциации дают катионы металлов и анионы кислотных остатков).
(cоли при диссоциации дают катионы металлов и анионы кислотных остатков).
Существуют электролиты, которые могут участвовать в химических реакциях как в роли основания, так и в роли кислоты. Такие электролиты называются амфотерными. К ним относятся оксиды и основания некоторых металлов: цинка, алюминия, свинца, олова, хрома(III) и некоторых других. Эти оксиды и основания способны реагировать как с кислотами, так и с основаниями, образуя в качестве продуктов реакции соли:
Al(OH)3 + 3HCl 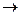 AlCl3 + 3H2O
AlCl3 + 3H2O
Al(OH)3 + NaOH  NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3 + 3NaOH  Na3[Al(OH)6]
Na3[Al(OH)6]
Sn(OH)2 + 2HCl  SnCl2 + 2H2O
SnCl2 + 2H2O
Sn(OH)2 + 2NaOH  Na2SnO2 + 2H2O
Na2SnO2 + 2H2O
Sn(OH)2 + 2NaOH  Na2[Sn(OH)4]
Na2[Sn(OH)4]
Дата добавления: 2016-11-22; просмотров: 873;
