Химическое равновесие
Если химическая реакция может протекать только в одном направлении, то она называется необратимой. Реакции, протекающие одновременно в двух направлениях, обратимы. С течением времени скорость прямой реакции (v 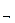 ) уменьшается, а скорость обратной реакции (v
) уменьшается, а скорость обратной реакции (v 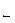 ) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
v 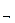 = v
= v 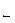 .
.
Состояние химического равновесия описывается константой равновесия, К.
Для обратимой химической реакции aA + bB  cC + dD
cC + dD
K = 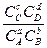 , где
, где
CA, CB, CC, CD - концентрации газообразных или растворенных веществ.
Состояние химического равновесия - динамическое. Его можно смещать. Смещение химического равновесия подчиняется принципу Ле Шателье (принципу противодействия): еcли на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяются температура, давление, концентрация одного из исходных веществ или продуктов реакции), то положение равновесия смещается в ту сторону, которая ослабляет внешнее воздействие.
Увеличение температуры вызывает смещение равновесия в сторону протекания эндотермической реакции (DH>0), а уменьшение температуры - в сторону экзотермической реакции (DH<0).
Увеличение давления в системе вызывает смещение равновесия в сторону меньшего количества газообразных веществ, а уменьшение давления - в сторону большего количества газообразных веществ.
Увеличение концентрации одного из исходных веществ вызывает смещение равновесия реакции вправо (в сторону его расходования, то есть в сторону образования продуктов реакции), а увеличение концентрации одного из продуктов реакции - влево.
Дата добавления: 2016-11-22; просмотров: 655;
