Химическая кинетика
Химическая кинетика изучает процессы протекания химической реакции во времени, а также механизмы химических реакций.
Реакции: а) гомогенные (отсутствуют границы раздела фаз между реагентами, протекают во всем объеме);
б) гетерогенные (протекают на поверхности раздела фаз).
Реакции: а) простые (элементарные) (протекают в одну стадию и отражаются записанным уравнением);
б) сложные (состоят из нескольких элементарных реакций);
Реакции: а) необратимые (хотя бы один из реагентов полностью расходуется в процессе реакции);
б) обратимые (в реакционной смеси всегда присутствуют как продукты реакции, так и исходные вещества).
Одним из основных понятий химической кинетики является понятие скорости химической реакции.
Под скоростью химической реакции понимают число элементарных актов реакции, в результате которых происходит превращение исходных веществ в продукты реакции, в единицу времени в единице объема.
На практике скорость реакций измеряют по изменению концентраций участвующих в ней веществ за определенный промежуток времени.

Очевидно, что в разные моменты времени концентрации реагирующих веществ изменяются, следовательно скорость реакции тоже изменяется. Мгновенная скорость реакции определяется пределом, к которому стремится выражение 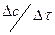 при
при 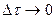 , т.е. производной концентрации по времени.
, т.е. производной концентрации по времени.
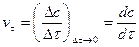
Графически мгновенная скорость может быть определена как тангенс угла a наклона кривой 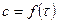 в точке, соответствующей какому-либо моменту времени.
в точке, соответствующей какому-либо моменту времени.
Из двух химических реакций с наибольшей скоростью идет та, в которой за одинаковое время образуется большее количество вещества.
Дата добавления: 2016-11-22; просмотров: 655;
