Б) Электрохимическая коррозия железа в контактной паре с медью
- Cравнить значения стандартных окислительно-восстановительных потенциалов (таблица);
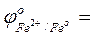
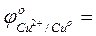
- ответить, какой из металлов - Fe или Cu - является более активным восстановителем;
- какой из металлов является анодным и какой – катодным участком;
- составить уравнение анодной реакции:
(процесс…………..…); (1)
- составить уравнение катодной реакции с водородной деполяризацией:
H2O + … → H2 + … (pH≥7, процесс……….…); (2)
- составить суммарное уравнение коррозии железа водой, объединив уравнения анодной (1) и катодной (2) реакции с учетом коэффициентов электронного баланса:
Fe + H2O →
- рассчитать ЭДС реакции коррозии железа водой в нейтральной среде:
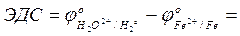
- составить уравнение катодной реакции с кислородной деполяризацией:
O2 + H2O + … → … (pH≥7, процесс………………); (3)
- составить суммарное уравнение коррозии железа кислородом в водной среде, объединив уравнения анодной (1) и катодной (3) реакций с учетом коэффициентов электронного баланса:
Fe + O2 + H2O → ….;
- составить рисунок, объяснить механизм электрохимической коррозии железа в контактной паре с медью;
- составить краткую схему образующегося коррозионного гальванического элемента;
- ответить, какие вторичные процессы коррозии могут протекать в данной системе;
- составить уравнение окисления гидроксида железа (II):
Fe(OH)2 + O2 + H2O →
- ответить, какие соединения могут входить в состав ржавчины;
- ответить, какое из покрытий - Cu или Zn - называют анодным; какое – катодным;
- какое из покрытий – анодное или катодное – защищает железо от коррозии даже после разрушения покрытия.
Вывод
Дата добавления: 2016-09-20; просмотров: 1601;
