Опыт 1. Гальванический элемент Даниэля-Якоби
Собрать гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинкового и медного - ивольтметра, встроенного во внешнюю цепь (рис.). Опустить цинковую пластинку в 1 М раствор соли сульфата цинка, медную пластинку в 1 М раствор соли сульфата меди (II). Отметить показания вольтметра. Соединить растворы электролитов – сульфата цинка и сульфата меди (II) - "солевым мостиком" ("электролитическим ключом"). Записать показания вольтметра.
- Выписать из таблицы значения стандартных окислительно-восстановительных потенциалов (ОВП) цинкового и медного электрода:
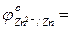 …
… 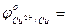 …;
…;
-более отрицательным значением окислительно-восстановительного потенциала характеризуется …………………….. электрод; более – положительным значением окислительно-восстановительного потенциала…………………………..электрод;
- при замыкании цепи «источником» электронов является………………………электрод;
- электроны во внешней цепи перемещаются от ………………………электрода к ………………….электроду;
- составить уравнение электродной реакции, протекающей на более отрицательно заряженном электроде:
(………………..реакция)
- ответить, какой процесс – окисления или восстановления – протекает на Zn – электроде;
- электрод, на котором протекает процесс окисления, называют ………………………
- составить уравнение электродной реакции, протекающей на более положительно заряженном электроде:
(………………..реакция)
- ответить, какой процесс – восстановления или окисления – протекает на Cu – электроде;
- электрод, на котором протекает процесс восстановления, называют …………………
- объяснить возникновение разности потенциалов между растворами электролитов (солей)
- в растворе сульфата цинка становится больше концентрация ионов…………………
- в растворе сульфата меди (II) становится больше концентрация ионов…………………
- ответить, в каком направлении перемещаются катионы и анионы по внутренней цепи;
- составить суммарное уравнение реакции, протекающей в гальваническом элементе, в ионной и молекулярной форме:
Zn + Cu2+ ®…;
Zn + CuSO4 ®…;
- краткая схема записи гальванического элемента Даниэля-Якоби;
- рассчитать ЭДС гальванического элемента Даниэля-Якоби в стандартных условиях:
ЭДС = φкат . – φан.;
- сравнить рассчитанное значение ЭДС с показанием вольтметра;
- назвать причины, по которым возможно уменьшение разности потенциалов между электродами по сравнению с рассчитанным значением ЭДС;
- объяснить, как изменяется ЭДС по мере работы гальванического элемента.
Дата добавления: 2016-09-20; просмотров: 1608;
