Лабораторная работа №3
на тему: «Электролиз водных растворов солей»
Цель работы:
- научиться составлять уравнения электролиза водных растворов солей;
- изучить закономерности протекания электролиза водных растворов солей.
Краткая теория.
Электролиз – это …
Потенциал разложения – это….
Потенциал разложения определяется…
Перенапряжение зависит от…
Поляризация электродов – это
При электролизе водных растворов вода может восстанавливаться на ………………………...в соответствии с уравнениями:
(в кислой среде)
(в нейтральной и щелочной среде)
Окислительно-восстановительный потенциал водородного электрода зависит от…………. и может быть рассчитан по уравнению ……………
При электролизе водных растворов вода может окисляться на ……………………….в соответствии с уравнениями:
(в кислой среде)
(в нейтральной и щелочной среде)
Окислительно-восстановительный потенциал кислородного электрода зависит от………… и может быть рассчитан по уравнению ……………
При электролизе водного раствора соли первым осуществляется процесс, характеризующийся…………………………….значением ………………………………….
На катоде первым ………………………..окислитель с ……………………..значением …
На аноде первым ……………………..восстановитель с ……………………..значением …
При электролизе водного раствора соли Na2SO4 протекают реакции
на катоде:
на аноде:
суммарное уравнение реакции:
При электролизе водного раствора соли NiCl2 протекают реакции
на катоде:
на аноде:
суммарные уравнения реакций
Опыт 4. Электролиз водного раствора иодида калия
В U-образную трубку налить раствор иодида калия. В оба колена добавить 4-5 капель фенолфталеина, опустить графитовые электроды, присоединить последние к блоку питания. Пропустить ток.
Отметить внешние изменения в растворе около электродов;
- составить уравнение электролитической диссоциации иодида калия в водном растворе:
KI →
- в растворе KI ……………………….среда;
- уравнение электролитической диссоциации воды:
- к отрицательно заряженному электроду перемещаются ионы………………….
- к положительно заряженному электроду перемещаются ионы…………………….
- возможные окислители:
- используя значения окислительно-восстановительных потенциалов, выбрать наиболее сильный окислитель:
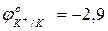 …………
………… 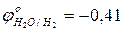 ; (pH=7)
; (pH=7)
- возможные восстановители:
- используя значения окислительно-восстановительных потенциалов, выбрать наиболее сильный восстановитель:
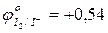 …………
………… 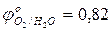 ; (pH=7);
; (pH=7);
- составить уравнение катодного процесса восстановления окислителя,
катодная реакция:
- составить уравнение анодного процесса окисления восстановителя,
анодная реакция:
- составить суммарное уравнение электролиза водного раствора KI, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса:
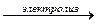 (ионное уравнение);
(ионное уравнение);
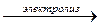 (молекулярное уравнение);
(молекулярное уравнение);
- рассчитать минимальный потенциал разложения (без учета перенапряжения), необходимый для протекания электролиза иодида калия;
- ответить, какие металлы не выделяются на катоде при электролизе водных растворов их солей.
Вывод:
Дата добавления: 2016-09-20; просмотров: 2125;
