Законы газового окисления. (Коррозия в газовых средах).
Адсорбция кислорода. Структура оксидов. Законы окисления, описываемые линейным, параболическим, кубическим законами диф-фузии. Катастрофическое окисление. Явления перелома в кинетике окисления.
Коррозия в газовых средах вызвана прежде всего наличием паров воды и кислорода. Кислород адсорбируется на поверхности с умень-шением свободной энергии. Молекулы имеют энергетический спектр (распределение Больцмана). Те из них, которые имеют энергию E > Eв способны приблизиться к поверхности на расстояние, меньшее xв
(где: Eв - вероятная энергия). Это приведет к тому, что молекула диссоциирует на атомы
О2 ---> О + О
Координата Хм соответствует стабильному равновесию адсорби-рованной молекулы, а Ха - стабильному равновесию атома кислорода.
Энергия диссоциации Eд вычисляется по (7.1)
Eд = Eв - E  (7.1 )
(7.1 )
Чтобы рекомбинировать в молекулу адсорбированный атом должен преодолеть энергетический барьер Еб:
Еб = Ев - E 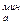 = E
= E 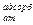 (7.2 )
(7.2 )
где E 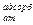 - энергия адсорбции атома.
- энергия адсорбции атома.
Из приведенного выше видно, что Еб > Eд, поэтому вероятность рекомбинации адсорбированных атомов кислорода меньше вероятно-сти диссоциации адсорбированной молекулы кислорода на атомы.
В итоге адсорбции на поверхности металла формируются двумер-ные поверхностные кислородные структуры.
Для каждого типа кристаллического строения металла существует наиболее вероятная конфигурация адсорбированного слоя. Эта конфи-гурация соответствует требованиям геометрии размещения атомов в металле и количеству связей между металлом и кислородом.
Это может быть (рис. 7.1) и другие типы.
 |
Рис. 7.1 Схема последовательного формирования
адсорбированного слоя атомов кислорода
После достижения определенной плотности адсорбированного ки-слорода [г-экв / см2] начинается процесс диффузии кислорода вглубь металла и образования трехмерной оксидной структуры после того как ядерная концентрация кислорода превысит некоторую пороговую.
Например, Zr образует оксид ZrO2 после того, как C 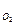 достигнет 29 %ат.
достигнет 29 %ат.
Обычно окисление начинается там, где есть поверхностные дефек-ты в металле и распространяется дальше на соседние объемы металла по законам диффузии. Но начинается все с оксида низшей валентности.
Например:
Fe à FeO à Fe3O4 à g -Fe2O3 à a -Fe3O4 (7.4)
У железа, ион металла диффундирует навстречу кислороду и оксид железа растет на границе раздела металл / газовая среда. У циркония - кислород диффундирует через оксид и оксид растет на границе раздела металл / оксид.
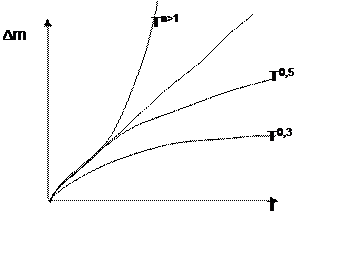 |
n=1
Рис. 7.2 Законы кинетики окисления в газовых средах
где: Δm - приращение (убыль) массы; n>1, n = 1, n=0,3, n=0,5 - степени при экспозиции в уравнении кинетики приращения (убыли) массы
Линейный закон окисления -Тn=1
Толщина оксидного слоя пропорциональна наработке:
X( t ) = K1 × t (7.5)
Это происходит обычно, когда объем образовавшегося оксида мень-ше объема металла, из которого образовался этот оксид и не покрывает сплошь поверхность ( не защищает металл ).
Параболический закон окисления -Тn=0,5
x × x = K2 × t (7.6)
Кубический закон окисления -Тn=0,31
x × x × x= K3 × t (7.7 )
Логарифмический закон окисления ( на рис. не приведен).
p × ln x = K3 + ln t (7.8)
Как правило эти законы (кроме линейного) реализуются на прак-тике. Оксиды в этих случаях - защитные, препятствующие диффузии кислорода ( металла ) и, тем самым, замедляющие окисление.
Катастрофическое окисление Тn>1
Это связано с тем случаем, когда температура плавления оксида T 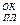
 (в К ) меньше, чем температура эксплуатации Тэкспл. В свою оче-редь Температура эксплуатации меньше, чем температура плавления металла: Тэкспл. < T
(в К ) меньше, чем температура эксплуатации Тэкспл. В свою оче-редь Температура эксплуатации меньше, чем температура плавления металла: Тэкспл. < T 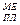 .
.
Кроме того, процесс окисления может усиливаться в случае если реакция образования оксида металла экзотермическая - с выделением теплоты.
На рис. 7.3. проиллюстрировано явление перелома в кинетике окисления металла. 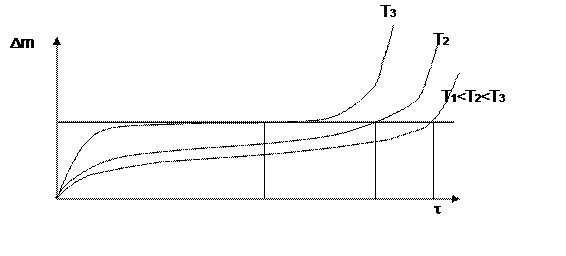
Рис. 7.3 Кинетика окисления при реализации явление перелома
Это связано с тем, что диффундирующий кислород охрупчивает металл (его подповерхностный слой). Кроме того, объем оксида боль-ше объема металла, из которого этот оксид образовался: Vок > Vме, что вызывает дополнительные растягивающие напряжения. Например, у Zr это отношение равно 1.52. Суммируясь с внешними приложен- ными напряжениями в конце концов эти напряжения вызывают растре-скивание подповерхностного слоя металла. При этом разрушается и оксид.
Трещина: во-первых увеличивает истинную поверхность, а вовто- рых облегчает доставку кислорода к свежему металлу. Это приводит к наблюдаемому кажущемуся ускорению процесса окисления. В то же время если приращение массы отнести к истинной поверхности (а не видимой,. то все станет на свои места и перелома не будет. Но будет трещина в металле, а это уже опасно.
| <== предыдущая лекция | | | следующая лекция ==> |
| ПРИЧИНЫ ПРОТЕКАНИЯ И КЛАССИФИКАЦИЯ ПРОЦЕССОВ КОРРОЗИИ | | | Раствор. Гомогенная смесь двух и более веществ. |
Дата добавления: 2016-06-02; просмотров: 1220;
