Раствор. Гомогенная смесь двух и более веществ.
Основы теории растворов, и электродные реакции.
Электролиты. Растворы. Растворимость, диссоциация,
Гидролиз. Законы Рауля, Генри электродные реакции.
Раствор. Гомогенная смесь двух и более веществ.
Различают газообразные, жидкие и твердые смеси - растворы. Условие одно - чтобы смесь можно было квалифицировать как раствор, необходимым и достаточным является условие равномерного распределения компонентов смеси по всему объему.
Однородную часть неоднородной системы называют фазой. Растворы описываются качественно: т.е. перечисляются компоненты и количественно - это уже когда называется некоторое соотношение между компонентами.
Различают следующие способы выражения количественного соотношения - концентрации.
а) объемная CV, [ г / литр ]
б) массовая Cm, [ г / г ], [ %масс ]
в) молярная Сmr - число молей на 1 л. раствора [ моль / л ]
г) молальная Сml - число молей на 1000 г растворителя [ моль / кг ]
д) нормальная CH, [ г-экв / л ]
Существуют таблицы пересчета из одной размерности в другую их надо знать, чтобы уметь правильно понимать результаты опытов других исследователей.
е) газовая концентрация [н см3(газа)/л ] - в жидком - и: [н см3(газа) /100 г. металла] - в твердом растворах
ж) массовая концентрация в единицах
ррm – ( parts per million ) à мг / кг ( ppm не путать с parts pro mile – частей на 1000 )
ppb – ( parts per billion ) à мкг / кг
При растворении имеет место фазовый переход, но нет химического взаимодействия.
В случае многокомпонентных растворов условие равновесия сводится к равенству парциального давления насыщенного пара каждого компонента для всех фаз. Имеется в виду равновесие в смысле:
растворение Û кристаллизация.
Давление насыщенного пара растворителя над раствором Pa всегда меньше, чем над чистым растворителем P0a.
Причина – относительная концентрация молекул растворителя снижается, следовательно и снижается число молекул переходящих с поверхности раствора в пар.
Понижение давления DP = Pao - Pa à пропорционально концентрации растворенного вещества в растворе. Относительное понижение давления насыщенного пара над раствором нелетучего компонента В:
[Pao - Pa] / P0a = Nв = Nmв / [ Nma - Nmв ] ( 8.1 )
где Nma, Nmв à молекулярные концентрации растворителя и растворенного вещества;
Nв à мольная доля.
Закон Рауля. С понижением давления насыщенного пара связано пони-жение температуры кристаллизации ( замерзания) и повышение температуры кипения; жидкость кипит, когда давление ее насыщенного пара равно внеш-нему давлению. Разница между tкип.о и tкип.р пропорциональна концентра-ции растворенного вещества:
tкип.о - tкип.р = Dtкип. = Kэб × c (8.2)
где Kэб à эбуллиоскопическая константа
для воды, если Cмл, то Kэб = 0,52 [ град кг / моль ]
Для очень разбавленных растворов:
Kэб = R( T0кип )
Kэб = R( Tкип.о )2 / 1000 × r
Для очень разбавленных растворов:
Kэб = R( Tкип.о )2 / 1000 × r
где Tкип.о, r à температура (К) кипения и теплота испарения [ кДж / кг ] растворителя;
Rà универсальная газовая постоянная.
Закон Генри. Концентрация Ci газа в жидкости пропорциональна парциальному давлению Pi этого газа над жидкостью:
Ci = K × Pi
Pi = Кг × e i à закон Генри (8.3)
где: Кг à константа Генри; K = 1 / Кг
Кг à измерены;
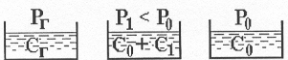
Электролит – вещество, сообщающее при растворении раствору способность проводить электрический ток ( к ним относятся кислоты, соли, основания ).
Способность пропускать электрический ток связана с наличием в растворе анионов ( имеют отрицательный заряд ) и катионов ( имеют положительный заряд и движутся к катоду ).
Наличие этих частиц объясняется диссоциацией (распадом) молекул элек-тролитов на отдельные разноименно заряженные частицы.
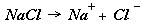
Образование ионов связано с гидратацией и ослаблением связей между ионами. Чем меньше ионов, тем меньше электропроводность раствора, ибо электролиты - проводники электрического тока 2 - го рода.
Из курса общей химии известно, что сильные электролиты характери-зуются константой диссоциации, слабые - степенью (Кd и a, соответствен- но):
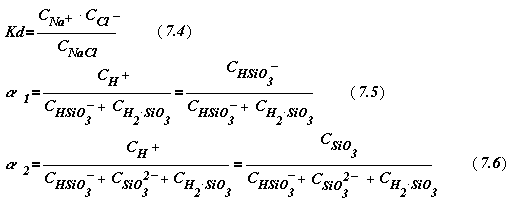
где a 1 и a 2 à соответственно, первая и вторая ступени диссоциации.
В концентрированных электролитах вокруг каждого иона возможна либо концентрация ионов противоположного знака, либо переориентация диполей воды т.е. создается ионная атмосфера. Из-за кулоновского взаимодействия этих зарядов затрудняется протекание реакций и создается эффект кажущегося понижения концентрации ( в сильных электролитах!!! ).
В разбавленных электролитах – расстояние между ионами велико, куло-новские силы - малы, поэтому там такого эффекта нет.
Для концентрированных электролитов применяют понятие активности
(вместо концентрации).
А= fi × Ci,
где fi à коэффициент активности;
lg f = - A× Zi^2× Öm / ( 1 + Öm )
n
m = 0.5 × å Ci × Zi^2 = 0.5 × å Cni × аi × Zi^2
i=1 i=1
где, m à ионная сила
Z à валентность
A = ( 1.823× 10^-6 ) / ( e / T )^3/2 ( 8.6 )
где, e à диэлектрическая проницаемость среды.
В частности активность хлорид -иона определяется по формуле:
aCl = CCl × g , [ г-ион / литр ] ( 8.7 )
lg g = 0.26 - 0.06 × lg CCl + 0.023 × (1000 / T)= 0.26 - 0.06 × lg CCl +
+ 23 / T) ( 8.9 )
Равновесие в растворах.
Равновесие обусловлено тем, что система, способная обмениваться энер-гиией с внешней средой, остается неизменной сколь угодно долго, пока не изменятся внешние условия.
Если процесс можно реализовать и в прямом, и в обратном направлении, это значит, что изменяются и состояние среды, и внешние условия.
Для того, чтобы процесс был полностью обратимым, необходимо чтобы он в каждой стадии был бы бесконечно близок к равновесному состоянию.
Если в равновесной системе присутствуют 4 компонента: А, B, D и E, уча-ствующие в реакции, то соотношение величин молярной концентрации Смл
этих веществ определяется константой равновесия.
Реакция :
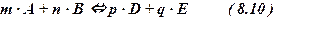
Kc = CDp × CEq / CAm × CBn ( 8.11 )
( CDp à читается так: молярная концентрация вещества D в степени p.
Если все это происходит в газовой фазе, то известно что при расширении газа и T = const производится работа:
U = p × DV или dU = p × dV ( 8.12 )
Из уравнения Клайперона - Менделеева pV = RT
выразим p = ( R × T / V ) × U и подставим в ( 8.12 ):
dU = R × T × dV / V ( 8.13 )
Проинтегрируем ( 8.13)
U = R × T × ln V2 / V1 (8.14 )
Изотермическое расширение однозначно связывает давление и объем:
p1 × V1 = p2 × V2 ( 8.15 )
Перепишем ( 8.14) с учетом (86.15)
U = R × T × ln p1 / p2 (8.16 )
Из закона Генри следует, что
C1 / C2 = p1 / p2 ( 8.17 )
Следовательно, работа при изменении концентрации вещества в растворе может быть вычислена по формуле:
U = R × T × ln p1 / p2 (8.18 )
То же, ноà через концентрации или через активности ( для сильных электролитов)
U = R × T × ln a1 / a2 ( 8.19 )
Если воспользоваться (8.11), (8,18) или (8.19), то можно вывести формулу для расчета работы по изменению концентрации реагирующих веществ от Ca и Cb до CA и CB. Соответственно и на выходе концентрации конечного продукта изменятся от Cd и Ce до CD и CE.
Работа при этом может быть подсчитана как изменение термического потенциала:
- DZ = U = R × T × ( ln Ca m / CA m + ln Cb n / CB n -
- ln Cdp / CD p - ln Ce / CEq ) = R× T × ( ln Kc - ln Cd p × Ceq / Ca m × × Cb n = R × T × ( ln Kc - ln DC ) ( 8.20 )
где Kc à константа равновесия.
Эта же формула для сильных электролитов примет вид:
- DZ = U = R × T × ( ln Ka - ln Da ) ( 8.21 )
Перенесение твердых тел в реакционное пространство не сопровождается работой, но их присутствие отражается на U и DZ, хотя их концентрации не входят в ( 8.20) и ( 8.21). Максимальная полезная работа совершается тогда, когда ln Da = 0, т.е. начальная ( исходная) концентрация и активность равны их конечным значениям.
DZ = - R × T × ln Kc ( 8.22 )
DZ = - R × T × ln Ka ( 8.22 )
U = n × F × j, где j = - R × T × ln Kc / ( n × F )
Константу равновесия можно выразить через степень диссоциации a;
Kc = Co × a2 / ( 1 - a2 ) ( 8.23 )
Ka = ao × a2 / ( 1 - a2 ) (8.23)
Константа равновесия существенно зависит от температуры.
Например вода - слабый электролит:
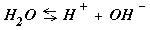
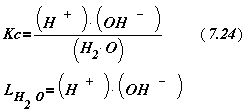 (8.24)
(8.24)
Для температур 290 К и 573 К LH2O равно:
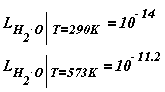
Это означает, что концентрация продиссоциировавших молекул растет с температурой. Это обстоятельство необходимо учитывать при оценке кор-розионной агрессивности среды.
Наличие кислой среды ( рН < 7) может привести к водородной хруп-кости. Наличие щелочи - к щелочной хрупкости.
Изменение рН среды может явиться следствием гидролиза. Например: NaAC à соль сильного основания ( NaOH ) и слабой кислоты ( АС ). Эта соль при растворении дает; NaAC « Na+ + AC-
причем CNa+ и [ AC- ] малы!
Продукт диссоциации воды H+ образует с AC- слабодиссоциирующую кислоту НАС. Выведение из ограниченного объема (норм отложений, щель, зазор) ионов H+ нарушает равновесие. Это восполняется немедленной диссоциацией других молекул воды. В свою очередь этот процесс приводит к накоплению гидроксил - иона OH-, т.к. он с Na- образует не только растворимые соединения – NaOH сильный электролит
NaAC « Na+ + AC-
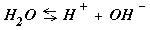
Следовательно ... « Na+ + OH- +HAC (8.25 )
Гидролиз может идти и по другому пути
Al2SO4 « 2 × Al+ + SO4 - -
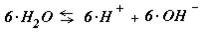
Следовательно ... « 2 × Al(OH)3 + 6×H+ +3× SO4 - - (8.26 )
т.е. при растворении соли сильной кислоты и слабого основания ограниченный объем подкисляется. Эти оба процесса характеризуются константой гидролиза KГ.
KГ = Сo × b2 / ( 1 - b ) (8.27 )
где b à степень гидролиза – доля молекул соли подвергшихся гидролизу.
В растворе было Сo молей соли NaAC, следовательно, Сo молей ионов AC-, из которых Сo × b было гидролизовано и осталось Сo × ( 1 - b ). Концентрация кислоты НАС и гидроксил - иона [ OH- ] одинаковы и равны Сo × b . Константа гидролиза - это отношение произведения концентраций продуктов гидролиза к концентрации негидролизованной соли.
KГ = [ HAC ] × [ OH- ] / [ AC- ] (8.28 )
b обычно << 1. Поэтому
bГ » Ö( KГ / Co ) (8.29 )
Если в воде присутствует Fe3+, то будет образовываться Fe(OH)3
Kc = [ Fe3+ ] × [ OH- ]^3 / [ Fe(OH)3 ]
LFe3+ = 10-38 [ г-ион / л ]2
LFe2+ = 1.4-15 [ г-ион / л ]2
в воде [ OH- ] = 10 -7, то есть [ OH- ]3 = 10-21
таким образом
CFe3+ = LFe3+ / [ OH - ]3 = 10-38 / 10-21 = 10-17 моль/л
CFe2+ = LFe2+ / [ OH - ]2 = 1.4-15 / 10-14 = 0.14 моль/л
Это обстоятельство необходимо учитывать при эксплуатации оборудова-ния. В сварных соединениях эта ситуация может быть реализована в зазорах под наплывом, где ограничен массообмен, а также под слоем осадочных отложений.
| <== предыдущая лекция | | | следующая лекция ==> |
| Законы газового окисления. (Коррозия в газовых средах). | | | При работе пары «медь/сталь» сталь локально растворяется и начинается образование питтинга |
Дата добавления: 2016-06-02; просмотров: 1321;
