ПРИЧИНЫ ПРОТЕКАНИЯ И КЛАССИФИКАЦИЯ ПРОЦЕССОВ КОРРОЗИИ
Определение процесса, причины протекания, термодинамический и электрохимический потенциал, типы, условия протекания , характер последствий коррозионного повреждения конструкционных сплавов, способы выражения скорости коррозии.
Как корродирует металл? По определению - процесс коррозии это разрушение металлов и сплавов под действием протекающих химических и электрохимических реакций.
Исходя из определения следует предпринимать все меры, чтобы замедлить скорость или даже прервать протекание химических и электрохимических реакций, чтобы продлить ресурс металла.
Почему корродирует металл? Рассмотрим на примере железа.
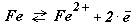 (6.1 )
(6.1 )
С позиций термодинамики знак ( >0 или <0) изменения свободной энергии между конечным веществом ZFe2+ и начальным ZFe указывает, в каком направлении идет реакция (окисление или восстановление).
Рассчитать DZ можно по формуле
DZ = ZFe2+ - ZFe ( 6.2 )
Знак «-» показывает, что реакция должна протекать только в прямом направлении - окисление, а в обратном нет. Поэтому металлы с DZ < 0 в природе встречаются в виде оксидов, солей и соединений, а имеющие DZ > 0 - находятся в самородном виде.
Практически все технические металлы термодинамически неустойчивы, а потому корродируют.
Несколько опережая события предлагаем мысленно опыт, который обычно демонстрируется в лаборатории химии на 1 курсе.
Подберем в электрохимической ячейке ( рис. 6.1) к установившемуся процессу растворения железа ( анод) катод из платины. Среда - 1 н. раствор CuSO4, насыщенный водородом при давлении 98 кПа. Это нормальный водородный элемент (НВЭ). Относительно него, считая
jНВЭ измеряют электрохимические потенциалы металлов.
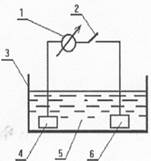
Рис. 6.1. Электрохимическая ячейка.
1 - гальванометр; 2 - ключ; 3 - сосуд ; 4 - электрод (анод); 5 - раствор CuSO4; 6 - электрод (катод)
Если растворить анодно 1 г-экв. железа (грамм-эквивалент это масса вещества в граммах, численно равная атомной массе, отнесенной к валентности), то выделится F = 96487 ± 0.5 кулон/г-экв. электричества; F - число Фарадея.
Работа пошла на перемещение зарядов в потенциальном поле с разностью потенциалов:
Dj = jFe2+ - j н = jFe2+ (6.3 )
Но изменение свободной энергии DZ - это то же работа согласно закону сохранения и превращения энергии:
DZ = Dj × F × n (6.4 )
или DZ = DjFe2+ × F × n (6.5)
отсюда DjFe2+ = DZ / F × n (6.6 )
При подстановке числовых значений вместо соответствующих символов:
DjFe2+ = - 83.74 / 2 × 96487 = - 0.44 B (6 .7 )
Так мы определили электрохимический потенциал железа.
Электрохимический потенциал золота + 1,7 B, а лития jLi+ = - 3.04 B.
Это стандартные потенциалы.
Но нас интересует прежде всего вопрос о скорости реакции.
КЛАССИФИКАЦИЯ
Процессы коррозии отличаются по механизму протекания: их, как уже отмечалось, два:
1. Химическая коррозия - процесс протекающий в газах и не электролитах и подчиняющийся законам химических гетерогенных реакций, не сопровождающийся возникновением электрического тока, Химическая коррозия - это процесс в котором окисление металла и восстановление окислительного компонента среды происходит в одном акте в один и тот же момент времени.
2. Электрохимическая коррозия - протекает в присутствии электрически проводящей среды, подчиняется законам электрохимической кинетики и сопровождается протеканием электрического тока.
В этом типе коррозии акты окисления и восстановления разделены пространственно и, как правило, разделены во времени.
По условиям протекания разделяют следующие виды электрохимической коррозии:
1) полное, частичное, переменное погружение;
2) щелевая;
3) при трении (частный случай - фреттинг-коррозия);
4) при кавитации;
5) контактная;
6) под действием внешних токов;
7) атмосферная;
8) подземная;
9) при постоянном нагружении ( КПН - частный случай - дентинг);
10) коррозионное растрескивание (КР);
11) водородное охрупчивание (ВО);
12) коррозия в космическом вакууме;
13) коррозионная усталость ( КУ ) - не имеет предела вынгсливости (в отличие от усталости на воздухе).
Характер наблюдаемых признаков коррозионных процессов.

а б) в)
Рис. 6.2. Общая коррозия.
а) исходное состояние металла; б) сплошная равномерная
коррозия; в) сплошная неравномерная коррозия;
в) 
а) б)
Рис. 6.3 а) язва d/n ~ 1 ; б) питтинговая d/n << 1 ; в) раковина
d/n >> 1 ; г) местная.
( d/n - отношение диаметра дефекта к его глубине)
Рис. 6.4 межкристаллитная ( МКК ) коррозия.

Рис. 6.5 транскристаллитное (ТКР ) коррозионное растрескивание (трещина через тело зерен ).

Рис. 6.6 межкристаллитное коррозионное ( МКР ) растрескивание.
( трещины по границам зерен ).
 |
Рис. 6.7 компонентно-избирательная ( КИК ) или селективная коррозия.
 | |||
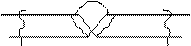 | |||
Рис. 6.8 ножевая - обычно поражает сварные соединения в околошовной зоне.
Рис. 6.9 корозионно - кавитационный износ.
Чем отличается коррозионная трещина от трещины механического происхождения? Тем, что она возникает при:
а) напряжениях, гораздо меньших sT , s0,2 , sВ;
б) меньшем числе циклов нагружения, чем это требуется для нагружения на воздухе;
в) механические характеристики металла вблизи коррозионной трещины;
г) шейки утонения остаются в пределах допустимых отклонений.
Таким образом, коррозия это не только (образно говоря) ржавое пятно на кузове автомобиля, а нечто более сложное, изучение которого позволит управлять долговечностью конструкционных сплавов.
СПОСОБЫ ВЫРАЖЕНИЯ СКОРОСТИ КОРРОЗИИ.
1) Гравиметрический -
1а) по убыли массы - потеря металла, переходящего в оксид.
v = [ go - gs( t ) ] / So × t , [ г / м2 × c ] ( 5.8 )
где go, gs( t ) - соответственно, исходная масса образца и масса прокорродировавшего образца, г.
t - экспозиция, с.
So - видимая поверхность, м2
1б) по приращению массы - прирост массы происходит за счет массы присоединенного к металлу ( в форме оксида) кислорода
v = [ gss( t ) - go ] / So × t , [ г / м2 × c ] ( 6.9 )
где gss( t ) - масса образца после испытаний.
1в) эту же скорость можно выразить в г-ат.
vат = v / A ( 5.10 )
где A - атомная масса металла.
2) Волюметрический ( объемный ) способ выражения скорости коррозии -
2а) по измерению объема поглощенного кислорода и 2б) по измерению объема выделившегося водорода.
Для 2а) характерно, что на 1 моль израсходованого кислорода окисляется m n г-экв. металла ( n - валентность, m - стехиометрический коэффициент в формуле оксида).
g - g = Dg = ( m × n × V / Vo2 )× A / n ( 6.11 )
где V, V 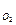 - объем израсходованного кислорода и его молярный объем в условиях опыта,
- объем израсходованного кислорода и его молярный объем в условиях опыта,
А - атомная масса металла.
Для 2б) характерно выделение 1 моля водорода Н2 на n г-экв. окисленного металла.
g - g = Dg = ( n × V / V H2 )× A / n ( 6.12 )
где V, V H2 - объем выделившегося водорода и его молекулярный объем в условиях опыта.
Преимущество этого метода - в том, что нет необходимости останавливать опыт ( прерывать ) для взвешивания образцов.
3. Измерение скорости коррозии в единицах плотности тока ( с использованием закона Фарадея).
( ia / F ) × A / n [ г / см2 × с ] , ( ia / F ) [ г - экв / см2 × с ] ,
( m / S × Dt ) / F(A / cм2 ) × [ Кл / c × см ]
v = k × ia × A / n × F ( 6.13 )
или ia = v / k × A
1-й; 2-й; 3-й способы относятся к сплошной равномерной коррозии.
Локальная коррозия измеряется скоростью подрастания дефекта вглубь. Это четвертый способ выражения скорости коррозии.
vh = H( t ) / t [ мм / год ] ( 6.14 )
где : H( t ) - глубина локального коррозионного дефекта.
Скорость подрастания трещины вдоль поверхности (параллельно ей)
vпар. = L( t ) / t [ мм / час ] ( 6.15 )
где: L( t ) - размер трещины вдоль поверхности
vпер = H( t ) / t ( 6.16 )
где: H( t ) - глубина трещины (перпендикулярно поверхности).
| <== предыдущая лекция | | | следующая лекция ==> |
| КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ ТВЕРДОГО ТЕЛА; ДЕФЕКТЫ, ДИСЛОКАЦИИ, ПОВЕДЕНИЕ ДИСЛОКАЦИЙ, РАЗМНОЖЕНИЕ, ПЕРЕМЕЩЕНИЕ. РАЗРУШЕНИЕ МЕТАЛЛОВ. | | | Законы газового окисления. (Коррозия в газовых средах). |
Дата добавления: 2016-06-02; просмотров: 2023;
