Примеры решения задач
Пример 8. Объясните, почему хлор - неметалл и марганец - металл помещают в одну группу периодической системы.
Решение. Электронные формы хлора и марганца можно изобразить следующим образом:
17Cl [Ne]3s23p5 25Mn [Ar]4s23d5
Oба элемента содержат по семь валентных электронов, поэтому имеют одинаковую максимальную положительную степень окисления +7. Однако, хлор относится к р-элементам (у него последним заполняется р-подуровень), поэтому он расположен в VII А группе, а у элемента Mn валентные электроны расположены на последнем четвертом энергетическом уровне s-подуровне и предпоследнем третьем уровне d-подуровне (он относится к d-металлам), поэтому он расположен в VII Б группе.
Пример 9. Составьте формулу высшего оксида мышьяка и соответствующей ему кислоты.
Решение. Мышьяк находится в пятой группе периодической системы, поэтому его максимальная степень окисления равна +5. Формула оксида – As2O5. Cогласно Периодическому закону мышьяк аналог фосфора и будет образовывать такие же кислоты. Кислоты образуются при взаимодействии кислотных оксидов с водой:
As2O5 + 3H2O = 2H3AsO4.
Пример 10. Какое из соединений: H2CO3, H2SiO3, HNO3 или H3PO4 имеет большие кислотные свойства?
Решение. Наибольшие кислотные свойства проявляет соединение, образованное наиболее активным неметаллом. Известно, что неметаллические свойства для элементов главных подгрупп возрастают сверху вниз, а в периодах при движении слева направо. Из приведенных выше кислотообразующих элементов: С, Si, N и Р – азот стоит правее и выше остальных, следовательно имеет самое высокое значение энергии сродства к электрону и большие неметаллические свойства.
Химическая связь
Строение химических соединений в основном определяется природой химической связи.
Химическая связьвозникает при взаимодействии атомов, обусловливающем образование химически устойчивой двух- или многоатомной системы (молекулы, кристалла и др.). Образование химической связи связано с общим понижением энергии системы взаимодействующих частиц.
Важнейшими характеристиками химической связи являются энергия, длина, углы между связями в молекуле.
Энергия связи – это количество энергии, выделяющейся при образовании химической связи. Обычно ее выражают в килождоулях на 1 моль образовавшегося вещества. Например, Есв(HF) = 536 кДж/моль; Есв(HCl) = 432 кДж/моль; Есв(HBr) = 360 кДж/моль; Есв(HI) = 299 кДж/моль. Чем больше энергия связи, тем прочнее связь.
Длина связи – это расстояние между ядрами атомов в молекуле. Длины связей обусловлены размерами реагирующих атомов и степенью перекрывания их электронных облаков.
По способу образования различают три основных вида химической связи: ионную, ковалентную, металлическую.
Ковалентная связь
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Она возникает между одинаковыми атомами, образующими газообразные двухатомные молекулы, а также в конденсированном состоянии с участием атомов неметаллов.
Согласно одной из существующих теорий образования ковалентной связи (метода валентных связей), валентность атома в химическом соединении равна числу образованных общих пар электронов.
Атомы образуют ограниченное число связей, равное их валентности. Это соответствует насыщаемости ковалентной связи.
В зависимости от числа неспаренных электронов, атомы могут образовать одну, две или три ковалентные связи, т.е. ковалентная связь характеризуется кратностью.
Наиболее прочные химические связи возникают в направлении максимального перекрывания АО. Поскольку атомные орбитали имеют определенную форму, их максимальное перекрытие возможно при определенной пространственной ориентации. Поэтому ковалентная связь характеризуетсянаправленностью.
В зависимости от направления перекрывания различают s, p и d-связи.
s - связь образуется при перекрывании АО вдоль оси, соединяющей ядра атомов.
p - связь образуется за счет перекрывания по обе стороны от оси, соединяющей ядра атомов.
d - связь возникает при перекрывания двух d-орбиталей, расположенных в параллельных плоскостях.
ГибридизацияАО также влияет на направленность ковалентной связи.
Гибридизация– это смешивание АО разных подуровней атома, электроны которых участвуют в образовании эквивалентных химических связей.
В зависимости от типа гибридизации гибридные орбитали имеют определенное положение в пространстве.
sp - линейные, угол 180°
sp2 - треугольные, угол 120°
sp3 - треугольные, угол ~ 109°
sp3d - треугольно бипирамидальные, угол 90° и 120°
sp3d2 - октаэдр, угол 90°.
В том случае, когда химические связи, образованные одинаковыми атомами, имеют различную кратность связи, наблюдается тенденция к делокализации (образованию многоцентровых связей, в которых одна пара электронов распределяется между тремя ядрами). Например, аноин СО32- имеет треугольное строение за счет sp2-гибридизации атома углерода. Три валентных электрона образуют три s-связи, расположенных под углом 120°, а четвертый участвует в образовании одной p-связи. Валентное насыщение одного атома кислорода достигается за счет образования p-связи, а двух других – за счет присоединения электронов. Известно, однако, что все три связи в карбонат-анионе равноценны, что говорит о делокализации p-связи и отрицательного заряда на все атомы кислорода:
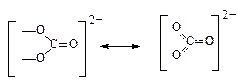
Общие пары электронов в молекуле смещаются к более электроотрицательному атому, таким образом ковалентная связь обладает свойством полярности. Молекулы, образованные одинаковыми атомами (Cl2, H2 и др.), имеют неполярные связи. Чем больше разность электроотрицательностей атомов, образующих химическую связь, тем она более полярна.
В зависимости от характера распределения электронной плотности между ядрами, молекулы подразделяются на полярные и неполярные. В неполярных молекулах центр тяжести положительных и отрицательных зарядов, полученных за счет полярности химических связей, совпадают. В полярных молекулах в одной части молекул преобладает положительный, а в другой отрицательный заряды.
Для образования полярной молекулы необходимо, чтобы молекула с ковалентными полярными связями была несимметрична. Молекулы N2 (линейная) и CCl4 (тетраэдрическая) симметричны, поэтому неполярны; молекула Н2О - угловая, несимметрична, поэтому полярна.
Например,
| неполярная молекула | полярная молекула |
| BH3 | NH3 |
| Тип гибридизации - sp2 | Тип гибридизации – sp3 |
| Форма молекулы – правильный треугольник | Форма молекулы - пирамида |
Полярные молекулы являются диполями.
Кроме обменного механизма, при котором каждый атом, образующий химическую связь, поставляет неспаренные электроны, существует также донорно-акцепторный механизм образования ковалентной связи, при котором один из атомов (донор) поставляет пару электронов, а другой (акцептор) – пустую орбиталь.
Например, при образовании иона аммония (NH4+) реализуются оба механизма образования ковалентной связи.
Электронная формула атома азота 7N 1s22s22p3 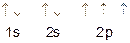 На последнем уровне он имеет пять электронов. Три из них - неспаренные, они принимают участие в образовании химических связей по обменному механизму. Пара электронов атома азота участвует в донорно-акцепторном взаимодействии с ионом Н+, не имеющем электронов на 1s-орбитали (азот выступает в качестве донора, а ион Н+ - акцептора электронов).
На последнем уровне он имеет пять электронов. Три из них - неспаренные, они принимают участие в образовании химических связей по обменному механизму. Пара электронов атома азота участвует в донорно-акцепторном взаимодействии с ионом Н+, не имеющем электронов на 1s-орбитали (азот выступает в качестве донора, а ион Н+ - акцептора электронов).
Метод валентных связей позволяет различить понятия валентность и степень окисления.
Валентность атома характеризует способность атома образовать химические связи и равна числу химических связей, образованных атомом.
Степень окисления – это условный заряд на атоме в молекуле, если предположить, что общие пары электронов полностью смещены к более электроотрицательному атому.
Например, валентность азота в молекуле NH3 равна III (атом азота образует три связи с атомами водорода). Т.к. электроотрицательность азота больше, чем электроотрицательность водорода, то общие пары электронов смещены в сторону азота, придавая ему отрицательный заряд (степень окисления равна -3). Валентность азота в ионе NH4+ равна IV. Три электрона водорода смещены в сторону азота, поэтому степень окисления равна -3.
Ионная связь
Ионная связь – это электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться как предельный случай ковалентной полярной связи (разность электроотрицательностей атомов, образующих химическую связь, превышает 2). Обычно считают, что ионная связь образуется при взаимодействии типичного металла и типичного неметалла.
Энергия ионной связи зависит:
1. от энергии электростатического взаимодействия между ионами, т.е. увеличивается с увеличением зарядов ионов и уменьшении их радиусов;
2. от энергии электронного сродства неметалла, которая увеличивается при увеличении неметаллических свойств элементов;
3. от энергии ионизации атомов.
Пример: образование молекулы хлорида натрия из атомов:
Na + Cl ® NaCl
Na ® Na+ + электрон Еi = 495 кДж (I)
Cl + электрон ® Cl - Еa = 345 кДж
Na+ + Cl - ® NaCl Eкул = 585 кДж
Есв = Екул + Еa – Еi = 435 кДж
Ионная связь ненаправленная и ненасыщаемая, что определяет большую устойчивость ионных кристаллов.
Дата добавления: 2016-11-22; просмотров: 3363;
