Взаимодействие молекул
(Конденсированное состояние вещества)
Химическая устойчивость молекул проявляется лишь в системах, где расстояние между молекулами много больше их размеров (r >>10-9м).
В том случае, если расстояние между молекулами составляет примерно 10-9 м, возникают Ван-дер-ваальсовы силы (при этом электронные облака соседних молекул не перекрываются и химическая связь не образуется).
Ван-дер-ваальсовы силы имеют электростатическую природу и подразделяются на:
1) ориентационные (диполь – дипольные);
2) индукционные (диполь – неполярная молекула);
3) поляризационные (дисперсионное взаимодействие мгновенно индуцированных диполей поляризуемых молекул). Притяжение между мгновенно индуцированными диполями увеличивается с увеличением поляризуемости молекул, то есть с увеличения их размеров и общего числа электронов. Так, среди галогенов поляризационное взаимодействие усиливается от хлора к иоду, поэтому Cl2 – газообразное вещество; Br2 – жидкость; I2 – кристаллическое вещество.
Ван-дер-ваальсово взаимодействие приводит к возникновению согласованного движения электронов в отдельных молекулах таким образом, что они все время находятся на максимальном расстоянии друг от друга.
Водородная связь имеет промежуточный характер между межмолекулярным взаимодействием и ковалентной связью. Это связь между положительно поляризованным атомом водорода и отрицательно поляризованными атомами с большой электроотрицательностью (F, O, N, S и др.).
За счет малых размеров атома водорода он имеет способность проникать в электрическую оболочку других атомов, где происходит взаимодействие, которое является промежуточным между электростатической и донорно-акцепторной связью.
Условно водородная связь записывается как Х – Н…Y (X, Y =F, O, N, S).
Донорно-акцепторное взаимодействие молекул возникает в том случае, когда один фрагмент молекул имеет свободные орбитали, а другой – пары электронов. Например, атом бериллия в молекуле BeCl2 имеет пустые орбитали на валентном уровне, а атомы хлора – пары электронов, поэтому в кристалле хлорид бериллия образует полимерные молекулы.
Донорно-акцепторное взаимодействие между разными молекулами приводит к образованию комплексных соединений:
AlCl3 + :NH3 ® H3N:AlCl3
Zn(OH)2 + 2 KOH ® K2[Zn(OH)4]
CuSO4 + 4NH3 ® [Cu(NH3)4]SO4
Примеры решения задач
Пример 11. Объясните образование молекулы хлорида бериллия.
Решение.
Рассмотрим электронные формулы бериллия и хлора:
В основном состоянии атом бериллия имеет спаренные валентные электроны, а в возбужденном состоянии - два неспаренных электрона, что и соответствует валентности Ве в молекуле BeCl2
4Ве 1s22s2.
| Be | ↑↓ | + hν → Be* | ↑ | ↑ | |||||||
| 2s2 2s1 2p1 |
Неспаренные электроны атома бериллия находятся на различных (s- и p- ) орбиталях, а связи Ве – Cl в молекуле ВеCl2 одинаковые. Это объясняется sp2-гибридизацией АО, когда из одной s- и одной р- АО образуются две sp-гибридные орбитали, имеющие одинаковую энергию и располагающиеся в пространстве под углом 180º. Молекула линейна. Два неспаренных электрона на гибридных орбиталях взаимодействуют с одиночными электронами атомов хлора с образованием двух σ-связей, расположенных под углом 180º
Пример 12. Объясните образование молекулы СО.
Решение.
В молекуле СО неспаренные электроны образуют две связи. Общие электронные пары, образующие эти связи смещены к атому кислорода:
2s| 2p
| С | ↑↓ |  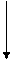
|  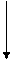
|  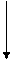
| |
| O | ↓↑ |
2p | 2s
Благодаря наличию пустой орбитали у атома углерода и неподеленных электронных пар у атома кислорода, по донорно-акцепторному механизму образуется третья связь. Это приводит к смещению электронной плотности от атома кислорода к атому углерода. Данное смещение настолько сильное, что избыточная электронная плотность оказывается не на атоме кислорода, а на атоме углерода. Молекула СО достаточно прочная, прочность молекулы сравнима с прочность молекулы N2. В структурных формулах две обменные cвязи изображаются черточками, а донорно-акцепторная – стрелкой, направленной от атома донора к атому-акцептору:
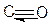
Пример 13. Пользуясь таблицей относительных электроотрицательностей (ОЭО), вычислите разность ОЭО для связей K-Cl, H-O, Cl-O, Fe-Cl, Na-F,Cl-Cl и дайте характеристику этих связей.
Решение.
Для того, чтобы дать характеристику связей этих пар атомов, используя таблицу относительных электроотрицательностей, нужно найти разность значений:
∆ОЭОCl-K = 3,0 – 0,8 = 2,2 - ∆ОЭО > 2, связь ионная;
∆ОЭОО-Н = 3,5 – 2,1 = 0,4 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОO-Cl = 3,5 – 3,0 = 0,5 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОCl-Fe = 3,0 – 1,9 =1,1 - ∆ОЭО < 1,5, связь ковалентная полярная;
∆ОЭОF-Na = 4,0 – 0,9 = 3,1 -∆ОЭО > 2, связь ионная;
∆ОЭОCl-Cl = 3,0 – 3,0 = 0 - ∆ОЭО = 0, связь ковалентная неполярная.
Дата добавления: 2016-11-22; просмотров: 1259;
