Примеры решения задач
Пример 5. Определите состав ядра атома изотопа 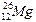 .
.
Решение. Порядковый номер элемента Mg – 12, следовательно, ядро этого элемента содержит 12 протонов. Массовое число атома – 26 – это сумма числа протонов и нейтронов: М = N(p) + N(n);
N(n) = M – N(p) = 26 – 12 = 14.
Пример 6. Составьте электронную формулу атома магния.
Решение. Магний имеет порядковый номер 12, следовательно его атом содержит 12 электронов. Так как магний находится в третьем периоде, электроны расположены на трех энергетических уровнях.
На первом энергетическом уровне имеются только s-электроны, на втором и на третьем s- и p- электроны (s- и p- подуровни). Максимальная емкость подуровня s- 2 электрона, подуровня р- 6 электронов.
Таким образом, электронную конфигурацию атома магния можно записать так: 1s22s22p63s2.
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 1s | 2s | 2p | 3s |
Пример 7. Составьте графические электронные формулы нормального и возбужденных состояний атома хлора и определите его возможные валентности.
Решение. Атом хлора имеет порядковый номер 17. Это значит, что атом содержит 17 протонов, (А – р) = 18 нейтронов и 17 электронов. В соответствии с правилами заполнения электронами атомных орбиталей составим формулу атома хлора:
17Cl 1s22s22p63s23p5
Валентные электроны хлора – это электроны последнего уровня:
(3s23p5). Графически схема заполнения электронами этих орбиталей имеет вид:
17Cl
| ↑↓ | ↑↓ | ↑↓ | ↑ | |||||||
| 3s | 3p | 3d |
В основном (невозбужденном) состоянии атом хлора имеет один неспаренный электрон и может проявлять валентность, равную I.
На последнем (третьем) знергетическом уровне атом хлора имеет свободные орбитали d-подуровня. При затрате некоторой энергии один из спаренных электронов хлора может быть переведен на свободную орбиталь d-подуровня, что соответствует первому возбужденному состоянию атома:
17Cl*
| ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ||||||
| 3s | 3p | 3d |
Возбужденное состояние атома отмечено звездочкой. В этом случае атом хлора имеет три неспаренных электрона, а его валентность равна III.
При затрате некоторой энергии следующая пара спаренных спинов р-подуровня может распариться, а атом хлора получит второе возбужденное состояние, которому может соответствовать следующее распределение электронов:
17Cl**
| ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 3s | 3p | 3d |
В этом случае атом хлора имеет пять неспаренных электронов, а валентность равна V.
Спаренные 3s-электроны также могут быть распарены на свободную 3d-орбиталь:
17Cl***
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||
| 3s | 3p | 3d |
В таком состоянии атом хлора имеет 7 неспаренных электронов, а валентность равна VII.
Таким образом, в соединениях хлор может проявлять валентности I, III, V, VII.
Дата добавления: 2016-11-22; просмотров: 1959;
