Влияние температуры
Скорость реакции зависит от числа эффективных столкновений. Эффективное столкновение происходит только между активными молекулами. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую энергию активации, и увеличивает скорость реакции.
Энергия активации – это та дополнительная энергия, которую нужно передать системе для начала химической реакции.
Энергия активации – один из основных параметров, который характеризует скорость химического взаимодействия. Она зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше (при прочих равных условиях) скорость реакции. Энергия активации необходима, в основном, для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами, которое возникает при сближении молекул и атомов взаимодействующих веществ и мешает их столкновению.
Правило Вант Гоффа. При увеличении температуры на 10° скорость реакции возрастает в 2 – 4 раза.
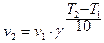 , где
, где
v2 - скорость реакции при температуре T2,
v1 - скорость реакции при температуре T1,
g - температурный коэффициент скорости, определяет изменение скорости реакции при изменении температуры на 10°. Для обычных реакций температурный коэффициент лежит в пределах 2 – 4. Исключение составляют ферментативные реакции, для которых g = 7 – 9.
Так как 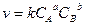 , то можно доказать, что
, то можно доказать, что 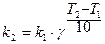 , то есть константа скорости реакции зависит от температуры.
, то есть константа скорости реакции зависит от температуры.
Так как 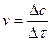 , то
, то 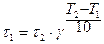 , где t - время реакции.
, где t - время реакции.
Уравнение Вант Гоффа лишь приблизительно оценивают зависимость скорости реакции от температуры. Более точную формулу установил шведский ученый С. Аррениус:
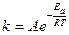 ,
,
где А – константа, не зависящая от температуры;
R – универсальная газовая постоянная (R = 8,31 Дж/К моль);
e – основание натурального логарифма (e = 2,72);
Т – абсолютная температура;
Еа – энергия активации реакции
Дата добавления: 2016-11-22; просмотров: 1128;
