Примеры решения задач
Пример 14. Составить математическое выражение для скоростей следующих реакций:
2NO(г) + O2(г) = 2NO2(г);
СаО(тв) + СО2(г) = СаСО3(т)
Решение. В соответствии с законом действующих масс скорость первой реакции должна быть прямо пропорциональна произведению молярных концентраций NO и О2, взятых в степени равной стехиометрическим коэффициентам:
V = k∙CNO2 ∙ CO2;
Для математического выражения скорости второй реакции (гетерогенной системы) учитываются только концентрации газообразных компонентов:
V = k ∙ CCO2.
Пример 15. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры реакционной смеси на 10ºС. Во сколько раз увеличится скорость реакции при повышении температуры от 30 до 60ºС?
Решение. По правилу Вант-Гоффа
V(T2) = V(T1)ּγT2-T1/10, следовательно,
V(T2)/V(T1) = γT2-T1/10= 360-30/10 = 33 = 27
Ответ: Скорость реакции увеличится в 27 раз.
Пример 16. Во сколько раз изменится скорость реакции при понижении температуры от 70 до 40ºС, если температурный коэффициент реакции равен 2?
Решение. По правилу Вант-Гоффа
V(T2) = V(T1)ּγT2-T1/10, следовательно,
V(T2)/V(T1) = γT2-T1/10= 2-3 = ½3 = 1/8.
Ответ: Скорость реакции уменьшится в 8 раз.
Пример 17. Как изменится скорость прямой реакции
2SO2(г) + O2(г) = 2SO3(г)
если уменьшить объем газовой смеси в три раза.
Решение. Скорость реакции до изменения объема:
V1 = k∙C2SO2∙CO2
При уменьшении объема системы в три раза во столько же раз возрастут концентрации реагирующих веществ (так как концентрация – это масса вещества в единице объема, при постоянной массе с уменьшением объема концентрация веществ возрастает). Тогда после уменьшения объема системы в три раза скорость реакции будет:
V2 = k∙(3CSO2)2∙3CO2 = 27k∙ C2SO2∙CO2
Т.е. скорость реакции увеличится в 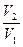 27 раз.
27 раз.
Пример 18. Вычислите равновесные концентрации [NO] и [O2] и константу равновесия реакции 2NO(г) + О2(г)  2NO2(г) , если исходные концентрации NO и О2 составляют по 0,08 моль/л, а равновесная концентрация [NO2] равна 0,06 моль/л.
2NO2(г) , если исходные концентрации NO и О2 составляют по 0,08 моль/л, а равновесная концентрация [NO2] равна 0,06 моль/л.
Решение. Согласно уравнению реакции на образование 0,06 моль NO2 расходуется 0,06 моль NO и 0,03 моль О2, следовательно, их равновесные концентрации равны:
[NO] = 0,08 – 0,06 = 0,02 моль/л; [O2] = 0,08-0,03 = 0,05 моль/л.
Подставим эти значения в выражение константы равновесия, получим:

Пример 19. В момент равновесия системы N2 + 3H2  2NH3 концентрации веществ составляют: [N2] = 5 моль/л; [H2] = 9 моль/л; [NH3] = 7 моль/л. Какова была исходная концентрация азота?
2NH3 концентрации веществ составляют: [N2] = 5 моль/л; [H2] = 9 моль/л; [NH3] = 7 моль/л. Какова была исходная концентрация азота?
Решение. Равновесные концентрации реагирующих веществ – это их концентрации в момент химического равновесия. По уравнению реакции из 1 моль N2 образуется 2 моль NH3, следовательно, для нахождения исходной концентрации азота нужно составить пропорцию:
из 1 моль N2 образуется 2 моль NH3;
из x моль N2 - 7 моль NH3,
откуда х = 3,5 моль N2.
Таким образом, исходная концентрация азота равна (5 + 3,5) = 8,5 моль/л.
Пример 20. В системе 3А + В 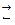 2С + D концентрации веществ А, В и С в состоянии равновесия равны соответственно 0,030; 0,010 и 0,008 моль/л. Найдите исходные концентрации веществ.
2С + D концентрации веществ А, В и С в состоянии равновесия равны соответственно 0,030; 0,010 и 0,008 моль/л. Найдите исходные концентрации веществ.
Решение. Концентрация веществ С и D в исходной смеси была равна нулю, то есть все они образовалось в процессе химической реакции. Согласно уравнению реакции, в 1 л равновесной смеси
n(D) = ½ n(C) = ½ × 0,008 = 0,004 (моль).
В процессе реакции исходные концентрации веществ А и В уменьшаются (идет их превращение в продукты реакции). Сравнивая коэффициенты в уравнении реакции, получаем: n(B) = n(D) = 0,004 моль; n(A) = 3×n(B) = 0,012 моль.
Исходные концентрации А и В – это суммы оставшихся и прореагировавших количеств:
| 3 A | + | B | 
| 2 C | + | D | |
| Взято, моль/л | 0,042 | 0,014 | |||||
| К моменту равно-весия прореагиро-вало, моль/л | 0,012 | 0,004 | |||||
| Образовалось, моль/л | 0,008 | 0,004 | |||||
| Осталось, моль/л | 0,030 | 0,010 |
Таким образом, исходная концентрация вещества А – 0,042 моль/л; исходная концентрация вещества В – 0,014 моль/л.
Пример 21. Какие факторы (давление, температура, катализатор) влияют на смещение равновесия в реакции: СО2(г) + С(тв)  2СО +∆Н в сторону образования СО? Ответ мотивируйте.
2СО +∆Н в сторону образования СО? Ответ мотивируйте.
Решение. Рассмотрим по очереди все факторы:
1.Давление. В правой и в левой части уравнения реакции есть газы. Однако V(CO2) = 2V(CO), поэтому по принципу Ле Шателье равновесие сместится в сторону уменьшения давления системы, т.е. влево. Чтобы сместить равновесие вправо, давление следует понизить.
2.Температура. Реакция идет с поглощением тепла. Следовательно, увеличение температуры смещает равновесие вправо.
3.Катализатор во всех случаях ускоряет наступление равновесия, но само равновесие не смещается.
АДСОРБЦИЯ
Адсорбция – это поглощение одного вещества поверхностью другого.
Абсорбция – это поглощение одного вещества в объеме другого.
Нескомпенсированность сил притяжения и отталкивания молекул вещества на поверхности приводит к возникновению поверхностного натяжения и способности к адсорбции молекул из окружающей среды:

По типу взаимодействия молекул поверхности (адсорбента) и молекул окружающей среды (адсорбата) адсорбцию делят на:
1.физическую (связана только с межмолекулярным взаимодействием. Такая адсорбция обратима и всегда сопровождается десорбцией);
2.химическую (сопровождается протеканием на поверхности химической реакции, например, возникновение оксидной пленки на поверхности металлов. Такая адсорбция необратима).
Адсорбция зависит от температуры (уменьшается при нагревании) и от давления (увеличивается при увеличении давления в случае адсорбции из газовой фазы).
Зависимость величины адсорбции от концентрации адсорбата (или давления) при постоянной температуре называется изотермой адсорбции:
Г = f(P)T = Const или Г = f(С)T = Const
Согласно теории Лэнгмюра, адсорбция происходит только в места максимального действия сил притяжения (активные места). Если все активные места поверхности заняты, то адсорбция не происходит. Если считать, что Г – адсорбция в данный момент времени, а Гmax – максимально возможная адсорбция (все активные места адсорбента заняты адсорбатом), то
Г / Гmax = q (степень заполнения поверхности);
1 – q - доля свободной поверхности, способной к адсорбции.
Скорость адсорбции пропорциональна концентрации адсорбата в окружающей среде и количеству свободных мест на поверхности адсорбента (доле свободных мест), а скорость десорбции пропорциональна числу занятых мест на поверхности адсорбента: v(адс.) = k(адс.)×( 1 – q) [адсорбат]
v(дес.) = k(дес.)× q.
При достижении равновесия v(адс.) = v(дес.);
k(адс.)×( 1 – q) [адсорбат] = k(дес.)× q;
k(дес.)/ k(адс.) = q / ( 1 – q) [адсорбат] = К.
Тогда Г = Гmax× K× [адсорбат] / 1 + K× [адсорбат]
В начальный момент адсорбции концентрация адсорбата на поверхности адсорбента мала, то есть 1 >> K× [адсорбат], знаменатель выражения близок к единице, Г = Гmax× K× [адсорбат], то есть адсорбция линейно зависит от концентрации адсорбата (линия 1 на графике).
После того, как все активные места адсорбции заняты, концентрация адсорбата велика, 1 << K× [адсорбат], знаменатель можно принять за K× [адсорбат], то есть Г = Гmax (адсорбция постоянна и не зависит от концентрации адсорбата, что отражается линией 2, параллельной оси абцисс). В промежутке зависимость Г от концентрации адсорбата нелинейна, что отражается изотермой адсорбции:
 Г
Г
 |
 [адсорбат]
[адсорбат]
ПОНЯТИЕ КАТАЛИЗА
Процесс изменения скорости химической реакции за счет введения в реакционную систему веществ, не входящих в состав продуктов реакции, называется катализом. Различают положительный и отрицательный катализ, то есть ускоряющий или замедляющий скорость данной реакции. Катализаторами называют вещества, увеличивающие скорость реакции и остающиеся после реакции в неизменном виде. Вещества, замедляющие скорость реакции называются ингибиторами.
Реакции, в которых один из продуктов является катализатором данного процесса, называются автокаталитическими.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа реагирующие вещества и катализатор находятся в одной фазе. Примером может служить окисление газообразного оксида серы (IV) до оксида серы (VI) с участием катализатора - оксида азота (IV) - тоже газа. Явление гомогенного катализа объясняется теорией образования промежуточных соединений, согласно которой в присутствии катализатора реакция протекает с его участием в несколько стадий. Схематично это может быть выражено так: А + В = АВ (реакция без катализатора идет медленно).
В присутствии катализатора К :
1-ая стадия А + К = АК (быстро, АК - промежуточное соединение)
2-ая стадия АК + В = АВ + К (катализатор К после реакции остается в химически неизменном виде).
Главной причиной ускоряющего действия гомогенных катализаторов является снижение энергии активации, необходимой для протекания реакции.
В гетерогенном катализе реагирующие вещества и катализатор находятся в различных фазах (как правило, катализатором является твердое вещество, на поверхности которого происходит ускорение реакции). Примером может служить реакция окисления оксида серы (IV) кислородом на поверхности платины. Механизм гетерогенного катализа заключается в адсорбции реагирующих веществ на поверхности катализатора (активных местах). Увеличение поверхностной концентрации приводит к увеличению скорости реакции. Продукты реакции десорбируются с поверхности катализатора.
Скорость гетерогенного катализа, как и скорость адсорбции, будет определяться числом активных мест на поверхности катализатора, а графическая зависимость аналогична изотерме адсорбции.
Гетерогенный катализатор всегда более активный, чем гомогенный катализатор (в большей степени увеличивает скорость реакции).
Биологический (ферментативный) катализ – это катализ биохимических реакций с помощью биокатализаторов – ферментов.
Особенности ферментативного катализа:
1. Высокая каталитическая активность ферментов (в сотни раз активнее неорганических катализаторов).
2. Биокатализаторы в отличие от неорганических катализаторов имеют высокую специфичность (один фермент, как правило, катализирует одну биохимическую реакцию).
3. Необходимость создания специальных условий (даже небольшое изменение рН и температуры приводит к изменению каталитических свойств ферментов).
РАСТВОРЫ
Растворы - этооднородные (гомогенные) системы переменного состава.
Растворы состоят по меньшей мере из двух компонентов – растворителя и растворенного вещества. За растворитель принимают обычно то вещество, которое сохраняет свое агрегатное состояние в процессе образования растворов или то, которое находится в избытке.
Количество (масса) растворенного вещества в единице массы или объема раствора называют концентрацией раствора.
Наиболее распространенные способы выражения концентрации растворов:
Массовая доля – это масса вещества в 100 г раствора:
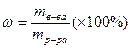
Молярная концентрация – это количество вещества в 1 л раствора:
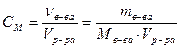
Молярная концентрация эквивалента (нормальная концентрация) – это число эквивалентов вещества в 1 л раствора:
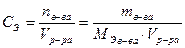
Растворимость – это способность одного вещества растворяться в другом при заданных условиях. Количественно она выражается коэффициентом растворимости, s. Он равен концентрации насыщенного раствора при данных условиях. В том случае, когда концентрация растворенного вещества меньше коэффициента растворимости, мы имеем дело с ненасыщенными растворами. В ряде случаев возможно получить пересыщенные растворы, однако они неустойчивы и легко выделяют избыток вещества, превращаясь в насыщенные растворы.
Растворимость веществ зависит от температуры и давления: для жидких и твердых веществ она увеличивается при повышении температуры, для газов – при понижении температуры и повышении давления.
Дата добавления: 2016-11-22; просмотров: 3456;
