Примеры решения задач
Пример 25. Рассчитайте ионную силу раствора, содержащего 0.02 моль/л CaCl2 и 0.05 моль/л Na2SO4.
Решение. Так как растворимые соли представляют собой сильные электролиты, то в растворе они полностью диссоциированы на ионы: CaCl2 ® Ca2+ + 2Cl–
Na2SO4 ® 2Na+ + SO42–
[Ca2+] = C(CaCl2) = 0.02 моль/л;
[Cl–] = 2C(CaCl2) = 0.04 мольт/л;
[Na+] = 2C(Na2SO4) = 0.1 моль/л;
[SO42–] = C(Na2SO4) = 0.05 моль/л.
m=1/2{[Ca2+]×Z2(Ca2+)+[Cl–]×Z2(Cl–)+[Na+]×Z2(Na+)+[SO42–]×Z2(SO42–)}
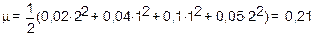 моль/л.
моль/л.
Диссоциация слабых электролитов
При диссоциации слабого бинарного электролита в растворе устанавливается равновесие.
CH3COOH  CH3COO- + H+
CH3COO- + H+
При этом, если начальная концентрация электролита равна С, а степень диссоциации a, то
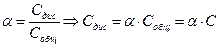
[CH3COO-] = [H+] = aC
[CH3COO-] = C - aC
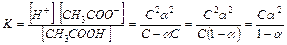
для a<<1 K=ca2 и 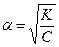
Приведенное уравнение выражает закон разбавления Оствальда, согласно которому степень диссоциации слабого электролита растет с разбавлением раствора.
Добавление в раствор слабых электролитов одноименных ионов вызывает смещение равновесия реакции диссоциации в сторону ее уменьшения (эффект одноименного иона).
Дата добавления: 2016-11-22; просмотров: 800;
