Закон действия масс
Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение происходит тем чаще, чем больше молекул содержится в данном объеме, т.е. скорость химической реакции зависит от концентрации реагирующих веществ.
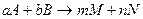
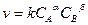
k – константа скорости химической реакции, численно равная скорости реакции при концентрациях реагирующих реагирующих веществ, равных 1моль/л;
a, b - простые числа, обычно не больше 3. Для простых реакций соответствует стехиометрическим коэффициентам.
Скорость реакции не зависит от концентрации твердого вещества, а только от площади их поверхности.
CaO + CO2  CaCO3
CaCO3
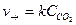
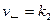
Кинетика сложной реакции лимитируется, т. е. определяется медленной стадией. Например, реакция 2HI + H2O2 ® 2H2O + I2 реально протекает в две стадии:
1. HI + H2O2 ® HOI + H2O (медленно)
2. HOI + HI ® I2 + H2O (быстро)
Выражение скорости этой реакции записывается как
 , а не
, а не 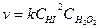
В химической кинетике взаимодействие классифицируют по признаку молекулярности реакции или порядка реакции.
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте реакции.
Реакции могут быть: мономолекулярными I2 ® 2I
бимолекулярными H2 + I2 ® 2HI
тримолекулярными 2NO+H2®N2O+H2O
Реакции более высокой молекулярности не встречаются.
Порядок реакции определяется зависимостью скорости реакции от концентрации каждого из реагирующих веществ.
Например, если скорость реакции aA + bB ® cC + dD, то 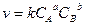 , то эта реакция а-го порядка по отношению A и порядка b по отношению к веществу В. Сумма показателей степеней (a+b) называется общим порядком реакции.
, то эта реакция а-го порядка по отношению A и порядка b по отношению к веществу В. Сумма показателей степеней (a+b) называется общим порядком реакции.
Порядок простой реакции определяется ее молекулярностью.
Порядок сложной реакции определяется порядком наиболее медленной стадии.
Дата добавления: 2016-11-22; просмотров: 623;
