Абсорбция и десорбция газов. Статика и кинетика процесса. Основное уравнение процесса абсорбции. Метод расчета. Устройство и принцип работы абсорберас подвижной насадкой.
Абсорбция- это процесс растворения газа или пара жидкостью, которая называется абсорбент или растворитель. Газы имеют различную растворимость в жидкостях. На этом свойстве широкое распространение абсорбции нашло как метод разделения газовых смесей с целью удаления из них вредного компонента или извлечения ценного компонента.
Адсорбция –процесс поглощения газов твердыми телами. Адсорбция применяется также, как и абсорбция, но только при условии когда извлекаемый компонент содержится в газе с незначительной концентрацией.
Обратный процесс абсорбции называется десорбция.
По ГОСТ-Р51858-02 нефть по содержанию H2S (сероводород) разделяется на 3 вида:
< 25 ppm (пипиэм, миллионные доли)
< 50 ppm
< 100 ppm. ( Гремиха > 200 ppm, мишкинское <100 ppm)
Статика процесса абсорбции.
Скорость перехода извлекаемого компонента из газовой фазы в жидкую пропорциональна концентрации. Одновременно на границе раздела фаз имеются  ламинарные слои со стороны жидкости и газа. При этом скорости перехода оказываются равными (газ и жидкость находятся в равновесном состоянии). Для идеальных растворов зависимость между равновесными концентрациями выражаются законом Генри:
ламинарные слои со стороны жидкости и газа. При этом скорости перехода оказываются равными (газ и жидкость находятся в равновесном состоянии). Для идеальных растворов зависимость между равновесными концентрациями выражаются законом Генри:
Р*к=Е*х (1)
где, Р*к –парциальное давление компонента в газе равновесном с жидкостью, Па;
Е –коэффициент Генри,
х – концентрация компонента в жидкости в мольных долях.
Закон Генри: Парциальное давление компонентов в газе, равновесного с жидкостью пропорционально его мольной доле в растворе:
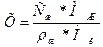 (2)
(2)
Сж –концентрация компонента в жидкости, кг/м3;
Мж –молекулярная масса жидкости, кмоль;
Ρж –плотность жидкости, кг/м3;
Мж –молекулярная масса извлекаемого компонента, кмоль.
Х*=Рк/Е, - со стороны жидкости.
В соответствии с законом Дальтона парциальное давление компонента в газовой смеси равно:
Рк =Р*у, (3),
Р- общее давление в газовой смеси,
У- концентрация компонентов газовой смеси в мольных долях,
Из (3) вытекает:
Рк* =Р*у*, (4),
Если совместно решить (1) и (4):
Ех=Р*у*, т.е. у*=(Е/Р)*Х – для газа
х*=(Е/Р)*у- для жидкости,
Обозначим m=Е/Р, т.е. у*= m *Х, х*=у/ m,
m – коэффициент распределения или константа фазового равновесия, он оценивает активность растворения газа в жидкости.
Различают хорошорастворимые, среднерастворимые, труднорастворимые газы в жидкости.
Хорошорастворимый газ – аммиак (NH3): Е=028 МПа,
Среднерастворимый газ – сероводород (H2S): Е=49 МПа,
Труднорастворимый газ – воздух Е=6720МПа, оксид азота (NОх) Е=5800 МПа.
С повышением температуры растворимость газа уменьшается, потому что, абсорбция является экзотермическим процессом. Так как при переходе молекул из газа в жидкость они становятся менее подвижными и выделяют тепло, поэтому подвод тепла к системе газ-жидкость вызовет обратный экзотермический процесс с выделением газа из жидкости. Растворение газа сопровождается уменьшением его объема, т.е. понижение давления и следовательно растворимость газа с повышением давления возрастает, т.е. процесс абсорбции следует проводить при наименьшей температуре и наибольшем давлении.
Связь между концентрацией для растворов:
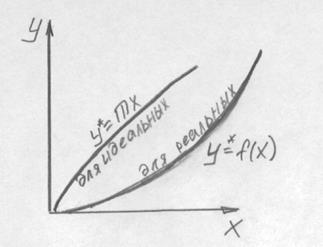
Степень отклонения системы от идеального раствора характеризуется коэффициентом активности, который дается в справочной литературе.
Дата добавления: 2016-08-07; просмотров: 3861;
