Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например уксусной кислоты:
CH3COOH ↔ CH3COО¯ + Н+
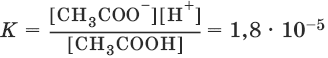
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов: чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее.
Многоосновные кислоты диссоциируют ступенчато:
Н3PO4 ↔ Н+ + Н2PO4¯
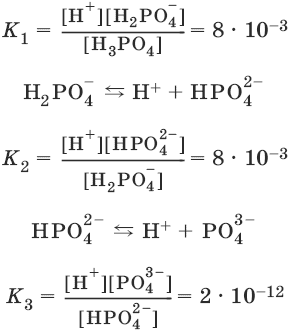
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Н3PO4 ↔ ЗН+ + PO43-
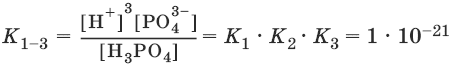
Закон разбавления Оствальда:степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
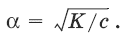
Влияние общего иона на диссоциацию слабого электролита:добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH ↔ CH3COО¯ + Н+ α << 1
сильного электролита, содержащего общий с CH3COOH ион, т. е. ацетат-ион, например CH3COОNa
CH3COОNa ↔ CH3COО¯ + Na+ α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
Дата добавления: 2016-04-23; просмотров: 1074;
