Окислительно-восстановительные реакции
Окислительно-восстановите льные реакции– реакции, которые идут с изменением степеней окисления элементов.
Окисление– процесс отдачи электронов.
Восстановление– процесс присоединения электронов.
Окислитель– атом, молекула или ион, который принимает электроны.
Восстановитель– атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1ē → Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
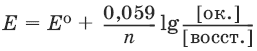
где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0 = 2,87 вольт, а для Na+ + 1ē ↔ Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0: ΔЕ0 = ΔЕ0ок – ΔЕ0восст , где Е0ок и ΔЕ0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nF ΔЕ0 или ΔЕ = (RT/nF) lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕ равна: ΔЕ = ΔЕ0 – (RT/nF) × IgK или ΔЕ = ΔЕ0 – (0,059/n )lgK .
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ = (0,059/n)lgK и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие ΔЕ0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ΔЕ0. Если ΔЕ0 > 0, реакция идет. Если ΔЕ0 < 0, реакция не идет.
Химические источники тока
Гальванические элементы– устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2+ + 2ē, а на медном электроде – восстановление: Cu2+ + 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0 = Е0ок – Е0восст = Е0 (Cu2+/Cu) – Е0 (Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элементсостоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы.Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42-
PbSO4(тв) + 2H2O → РbO2(тв) + 4H+ + SO42- + 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42- → PbSO4(тв) + 2ē
РbO2(тв) + 4H+ + SO42- + 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
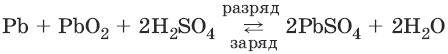
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Растворы
Дата добавления: 2016-04-23; просмотров: 952;
