в історичному аспекті 37 страница
Незважаючи на досягнення сучасної медицини, генералізована інфекція
і сепсис залишаються однією з провідних причин летальності серед стаціо-
нарних хворих. Висока летальність обумовлена, як правило, грамнегативни-
ми бактеріями (у 2 рази вище, ніж у випадках грампозитивної мікрофлори)
і грибами. Найвища летальність, яка досягає 80-90 %, спостерігається серед
пацієнтів з поліорганною недостатністю.
Все частіше причиною розвитку сепсису стає нозокоміальна (внутрішньо-
лікарняна) інфекція. По даними ВООЗ, більше, ніж у 60 % випадків, клініч-
но маніфестна госпітальна інфекція викликається антибіотикорезистентними
штамами мікроорганізмів.
Важливо розуміти, що сепсис розвивається в результаті збою в імунній
відповіді, при цитокіновій регуляції відбувається переключення саногенетич-
ної імунної реакції на патогенетичну. До факторів, які викликають порушення
адекватної імунної відповіді, належать: властивості збудника, надмірно велике
антигенне навантаження, імунні дефекти різного генезу, застосування глюко-
кортикоїдів, імунодепресантів, цитостатиків, антиметаболітів, а також прове-
дення інвазивних методів обстеження і лікування.
У процесі багаторічних досліджень етіології і патогенезу сепсису виникла
плутанина у чисельних термінах (сепсис, септичний синдром, септичний шок,
септичний стан). Класичне визначення сепсису (початок XX століття) як наяв-
ності в організмі вогнища, з якого до кровоносного русла постійно або періо-
дично надходять патогенні збудники, застаріло і мало придатне для клінічного
застосування.
Останніми роками відбулися істотні зміни в трактуванні поняття сепсису і
його патогенезу. При цьому провідне значення надають так званим вторинним
порушенням функції імунної системи, що виникають у результаті застосуван-
ня кортикостероїдних і цитостатичних препаратів, а також збільшенню кіль-
кості пацієнтів із набутими імунодефіцитними захворюваннями, вторинною
імунною недостатністю, ВІЛ-інфікованих.
Численні дослідження сепсису у хворих різних категорій призвели до ви-
никнення великої кількості визначень цього захворювання і його класифікацій.
В основу запропонованих класифікацій були покладені різні ознаки:
1. Перебіг хвороби (блискавичний, гострий, підгострий, хронічний, реци-
дивний).
2. Локалізація і наявність збудника в місці вхідних воріт (первинний, вто-
ринний, криптогенний).
3. Характер вхідних воріт (рановий, гнійно-запальний, опіковий та ін.).
4. Локалізація первинного вогнища (акушерсько-гінекологічний, ангіоген-
ний, уросепсис, пупковий та ін.).
5. Етіологічна ознака (грамнегативний, грампозитивний, стафілококовий,
стрептококовий, псевдомонадний, грибковий і т.д.).
З метою внесення термінологічної визначеності і чіткості для характерис-
тики хворих у критичному стані на конференції Американської колегії ліка-
рів і Товариства критичної медицини США був прийнятий термін "синдром
системної запальної відповіді" (ССЗВ). Таким чином, на сьогодні під сепси-
сом розуміють системну реакцію на інфекцію, що проявляється синдромом
системної запальної відповіді (англ. SIRS - System inflammatory responsitive
syndrome). Слід зазначити, що цілком ототожнювати сепсис зі ССЗВ не мож-
на, оскільки останній є системною реакцією організму не тільки на інфекцію,
але і на різноманітні екстремальні впливи й агресію: травму, опіки, повторні
оперативні втручання, радіаційні ушкодження, шок, важкі соматичні розлади
(наприклад, цироз печінки), рак, імунодефіцит. Якщо бути послідовним в ін-
терпретації нових теоретичних поглядів, то більш логічно визначати сепсис як
ССЗВ (SIRS) інфекційного генезу.
Таким чином, SIRS може розвиватися внаслідок різноманітних причин
(ішемія, ушкодження тканин, запалення), що призводять до вторинного ви-
вільнення цитокінів та інших біологічно активних речовин, які викликають
розвиток поліорганних порушень.
В умовах сепсису ініціаторами вивільнення біологічно активних речовин
(цитокінів, ферментів, гістаміну, кінінів, арахідонової кислоти, простагланди-
нів, оксиду азоту й інших продуктів) є мікроби, їхні токсини й алергени.
Як сполучну ланку між мікробним сепсисом і немікробним SIRS вбача-
ють феномен транслокації бактерій і ендотоксинів з кишківника внаслідок
його ішемії при розвитку загального запального процесу.
§2. Етіологія і імунопатогенез сепсису
Збудниками сепсису можуть бути патогенні й умовно-патогенні мікроор-
ганізми: бактерії (стафілококи, пневмококи, менінгококи, кишкові палички,
синьогнійні палички, мікобактерії туберкульозу, кдебсієли й ін.), віруси гер-
петичної групи, гриби (Candida, Aspergillus й ін).
Патогенез. Генералізація інфекції обумовлена переважанням активності
збудника над бактеріостатичними можливостями організму. Зазначена ситуа-
ція можлива в результаті масивної інвазії, порушення функцій бар'єрних тка-
нин або в умовах імунодефіцитних захворювань різного генезу (спадкових,
природжених і набутих). Порушення імунітету, які передують сепсису, часто
залишаються непоміченими. Варто підкреслити, що сепсис виникає не в ре-
зультаті порушення імунітету взагалі, а внаслідок зриву в одній з його ланок,
що призводить або до порушення синтезу антитіл, або до зниження фагоци-
тарної активності нейтрофілів, або до порушень проліферації лімфоцитів.
Тому в більшості випадків сепсис початково обумовлений одним збудником,
розмноженню якого повинна перешкодити активація скомпрометованої ланки
імунного захисту. У середньому лише в 10 % випадків сепсис обумовлений
комбінаціями збудників. Одночасне співіснування декількох збудників або за-
міна збудника при сепсисі спостерігаються при наступних умовах:
• при імунодепресії, викликаній застосуванням цитостатиків;
• при тяжкому імунодефіцитному захворюванні;
• при депресії кровотворення як результату аплазії кісткового мозку або його
лейкемічного ураження;
• при надмірно інтенсивній інсоляції, яка пригнічує імунну відповідь на де-
кількох рівнях;
• при порушеннях імунітету, пов'язаних з відсутністю селезінки;
• при порушеннях Т-клітинної (хелперної) ланки імунітету в умовах СНІДу.
Повторна септична бактеріальна інфекція найчастіше розвивається при
дефектах системи комплементу (нейсерії), а також при недостатності фа-
гоцитозу (кокова флора) і дефіциті антитіл (паличкова флора). При грубих
дефектах імунітету розвиваються так звані опортуністичні інфекції, які ви-
кликаються умовно-патогенною мікрофлорою або навіть сапрофітами (та-
блиця 58).
Таблиця 58.
Збудники сепсису при різних клінічних ситуаціях
| Клінічна ситуація | Причина змін | Збудник |
| Відсутність очевидних причин імунодефіциту | Цитостатична, стероїд- на терапія | Пневмокок або стафіло- кок, рідше менінгокок |
| Внутрішньолікарняне інфікування | Цитостатична терапія | Грамнегативна мікрофло- ра: кишкова, синьогнійна паличка, протей |
| Аневризма аорти, фільтр нижньої по- рожнистої вени, кате- тер підключичної вени | Інфікування тромбу | Стафілокок, синьогнійна паличка, пневмокок |
| Лімфопроліферативні захворювання, лімфоми, лімфогранулематоз | Зниження противірус- ного імунітету | Герпетичні інфекції: ві- тряна віспа, оперізуючий лишай, простий герпес |
| Спадкові нейтропенії | Порушення нейтрофі- лопоезу | Рецидивні стафілококові інфекції |
| Тривале застосування стероїдних гормонів | Хронічні або гострі бакте- ріальні септичні процеси, можливий туберкульозний сепсис |
Все ж таки в центрі уваги патофізіології сепсису лежить не збудник, а ви-
кликана бактеріальним токсином надмірна запальна реакція організму. Сьогодні
вважають, що саме ця гіперзапальна реакція імунної системи (так зване "боже-
вільне запалення") призводить до розвитку септичного шоку (схема 10).
Для подолання існуючих протиріч у розумінні патогенезу сепсису кон-
сенсусна конференція Товариства критичної медицини і торакальних лікарів
СІЛА APCP/SCCM запропонувала схему, наведену в табл. 59. Відповідно
до рішення конференції, діагностика сепсису повинна ґрунтуватися на клі-
нічних критеріях і не потребує обов'язкового виявлення збудників у гемо-
культурі.
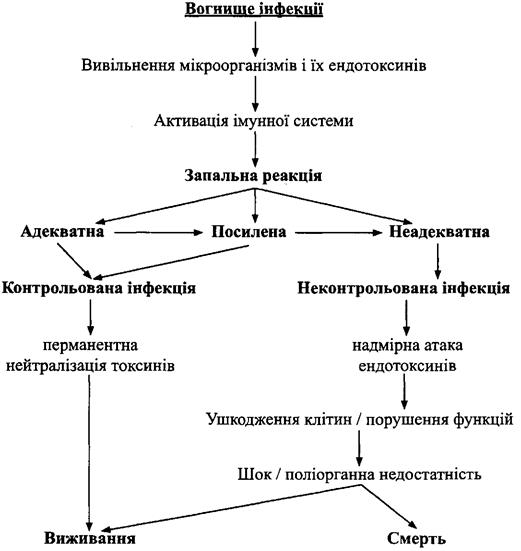
Схема 10. Принципова схема патогенезу сепсису
Таблиця 59.
Визначення сепсису відповідно до рішення консенсусу APCP/SCCM
| Інфекція: Запальна реакція на наявність мікроорганізмів або на проникнення їх до стерильних тканин |
| Бактеріемія: Наявність живих бактерій у крові |
Продовження табл. 59
Синдром системної запальної відповіді (SIRS):
Системна запальна реакція на екзо- й ендоінтоксикацію, яка виникає в
результаті наступних причин: інфекція, панкреатит, пошкодження тканин,
травма, ішемія, екзогенне введення запальних медіаторів, наприклад, ФНП-сс.
Цей синдром проявляється двома або більшою кількістю ознак:
• температура тіла - вище 38 °С або нижче 36 °;
• тахікардія - ЧСС більше 90 на хвилину;
• тахіпное - ЧД більше 20 на хвилину або рС02 менше 32 мм рт. ст.
• лейкоцити >12х109 або < 4><109в 1 л крові, або незрілі форми > 10 %
Сепсис: SIRS + наявність збудника (патогену)
Тяжкий сепсис: сепсис + порушення перфузії або артеріальна гіпотензія.
Порушення перфузії можуть призвести до виникнення лактат-ацидозу,
олігурії або гострого порушення ментального статусу, але не обмежуються
перерахованою симптоматикою
Септичний шок:
сепсис + дисфункція органів + артеріальна гіпотензія
Артеріальна гіпотензія визначається як систолічний тиск крові менше 90
мм рт. ст. або діастолічний тиск нижче 40 мм рт. ст. за відсутності інших причин
гіпотензії. Під впливом лікування судинозвужувальними або інотропними
агентами тиск може нормалізуватися при збереженні порушень перфузії.
Синдром поліорганної дисфункції (недостатності):
Дисфункція органів у пацієнта, що виникає при неадекватній терапії сепсису
і проявляється наступними видами розладів:
- РДС - респіраторний дистрес-синдром;
- ДВЗ - синдром дисемінованого внутрішньосудинного зсідання крові;
- ГНН - гостра ниркова недостатність, яка переходить у шок, рефрактерний
до терапії;
- ГПН - гостра печінкова недостатність;
- Порушення центральної нервової системи
§3. Механізми розвитку синдрому системної запальної
відповіді при сепсисі
У нормі потужний імунний каскад забезпечує швидку захисну відповідь
на вторгнення мікробів до організму людини. При недостатності імунного захисту інфекція може швидко генералізуватися. З іншого боку, надмірна або
погано відрегульована імунна відповідь також здатна нашкодити організму у
зв'язку з масивним вивільненням ендогенно синтезованих прозапальних речо-
вин, які призводять до розвитку системного запалення.
Загальні механізми розвитку SIRS. Інфекція клінічно проявляється тоді,
коли мікроорганізми проникають через фізіологічні бар'єри організму (шкіру
і слизові оболонки) або певним чином "оминають" їх (наприклад, при парен-
теральному зараженні). Мікроорганізми і їх токсичні продукти надходять до
циркуляції й активують механізми природженої резистентності. До останніх
належать гуморальні фактори: система комплементу, калікреїн-кінінова
система і каскад зсідання крові, а також клітинні компоненти: нейтрофіли,
моноцити, макрофаги і клітини ендотелію. Зазначені клітини, активовані за-
хопленням патогену або його токсинів, продукують медіатори, які ініціюють і
підтримують запальну реакцію. До таких медіаторів належать доімунні цито-
кіни (фактор некрозу пухлини а [ФНП-а], інтерлейкін ір [ІЛ-ір], інтерлейкін
6 [ІЛ-6]), кініни, метаболіти арахідонової кислоти (простагландини і лейко-
трієни), фактор активації тромбоцитів і оксид азоту (N0). Гіперзапальна ре-
акція організму поряд із прямою пошкоджуючою дією мікробних екзотоксинів
здатна призвести до ушкодження клітин, порушення перфузії органів і тканин
і, зрештою, до розвитку шоку, поліорганної недостатності і смерті (схема 11).
Пусковий фактор, наприклад мікробний ендотоксин, запускає процес утво-
рення прозапальних цитокінів макрофагами (фактора некрозу пухлини а й
інтерлейкіну ір). Ці цитокіни посилюють адгезійні властивості нейтрофілів,
сприяючи їх фіксації на ендотеліальних клітинах, активують процеси зсідання
крові, а також визначають утворення численних вторинних запальних меді-
аторів (інших цитокінів, простагландинів, лейкотрієнів, протеаз). Щоправда,
вивільняються і протилежно діючі фактори (зокрема, інтерлейкін 6 та інтер-
лейкін 10), які наділені антизапальними властивостями, що до певного сту-
пеня врівноважує запальний процес. Однак варто враховувати, що потенці-
ал протизапальних цитокінів є значно нижчим, аніж прозапальних (інакше
імунна система була б не здатною розвивати ефективну протимікробну від-
повідь). З іншого боку, навіть ті цитокіни, що номінально відносяться до про-
тизапальних, наділені перехресними властивостями, що пояснює їх часткові
прозапальні ефекти. Так, наприклад, ІЛ-6 збільшує продукцію гепатоцитами
С-реактивного білка, який активує комплемент і фагоцитоз, що призводить до
посилення запалення.
Таким чином, ключовим елементом розвитку SIRS є цитокіни, які проду-
куються організмом хазяїна - так звані плеоморфні імунорегуляторні пептиди.
До найбільш досліджених цитокінів належать фактор некрозу пухлини а, інтерлейкін ір та інтерлейкін 8, наділені прозапальною функцією, а також інтер-
лейкін 6 та інтерлейкін 10, які є, навпаки, антизапальними медіаторами.
Інтерлейкін ір і ФНП-а є синергістами, оскільки здійснюють багато
спільних біологічних ефектів. Інгібування синтезу зазначених цитокінів по-
ліпшує функціонування і виживання органів в експериментальних моделях
сепсису.
Інтерлейкін 8 (нейтрофільний хемотаксичний фактор) відіграє особливо
важливу роль у підтриманні запалення, оскільки сприяє спрямованому пере-
міщенню нейтрофілів до місця перебування патогену.
Інтерлейкіну 6 та інтерлейкіну 10 притаманні контррегуляторні ефекти.
Вони інгібують утворення ФНП-а, посилюють дію білків гострої фази й іму-
ноглобулінів, пригнічують функції Т-лімфоцитів і макрофагів. Однак ефек-
тивність препаратів цих цитокінів щодо зниження летальності серед хворих
сепсисом досі не доведена.
Саме сумарні ефекти, до яких призводять зазначені медіатори, і обумов-
люють формування системної запальної реакції, або синдрому системної за-
пальної відповіді. Виділяють три стадії у перебігу цього синдрому.
Стадія 1. Локальна продукція цитокінів у відповідь на надмірне ушко-
дження або інфекцію.
Стадія 2. Захисне вивільнення незначної кількості цитокінів до кровотоку.
Стадія 3. Масивна системна реакція, обумовлена генералізованою дією
прозапальних цитокінів на капілярні стінки, що призводить до порушення сис-
теми мікроциркуляції.
У тому випадку, коли регулюючі системи не здатні підтримувати гомеос-
таз, деструктивні ефекти цитокінів та інших медіаторів домінують, що призво-
дить до порушення проникності й інших функцій ендотелію капілярів, запуску
ДВЗ-синдрому, розвитку моно- і поліорганної дисфункції. На цій стадії ССЗВ
(SIRS) взаємодія про- і антизапальних медіаторів проходить у дві фази.
Початковий період - гіперзапалення (так зване "божевільне запалення"),
яке характеризується вивільненням надвисоких концентрацій прозапальних
цитокінів і оксиду азоту, які приводять до розвитку шоку і формуванню син-
дрому поліорганної недостатності (СПОН).
Кінцевий період характеризується розвитком компенсаторної антизапаль-
ної відповіді, яка призводить до зниження функціональної активності імуно-
компетентних клітин, тобто до розвитку так званого "імунного паралічу".
Принципове значення у розвитку імунного паралічу має виснаження проза-
пальних механізмів.
Головним фактором ініціювання ССЗВ є бактеріальний ендотоксин -
комплексний компонент клітинної стінки грамнегативних бактерій, представ-
лений ліпополісахаридною субстанцією (LPS). Токсичний ефект зазначеної
субстанції обумовлений ліпідом А. Ендотоксини окремих видів грамнегатив-
них бактерій, хоча і відрізняються за деталями, мають загальну структуру.
Вони є молекулярними комплексами, які складаються з численних антигенних
полісахаридних ланцюгів, зв'язаних з гідрофобним ліпідом А. Ці структури
локалізовані в клітинній стінці бактеріального агента, що забезпечує їх спе-
цифічне розпізнавання імунною системою організму. Розпізнавання антигену
є ініціатором каскаду вивільнення медіаторів, зокрема, цитокінів з наступним
розвитком властивої їм пошкоджуючої дії. Таким чином, токсичний ефект лі-
піду А багато в чому є непрямим і обумовлений масивним вивільненням про-
запальних цитокінів.
Ендотоксини чинять набагато більш виражену біологічну дію при вивіль-
ненні в кров. Це відбувається в результаті загибелі мікроорганізму під дією
комплементу, при фагоцитозі або застосуванні антибіотиків з бактерицидною
дією. При цьому має значення як "агресивна антибіотикотерапія", яка призво-
дить до лавиноподібного надходження ендотоксину в кров, так і застосування
субтерапевтичних доз антибіотиків із профілактичною метою.
Величезним резервуаром бактеріальних ендотоксинів є кишківник. Не ви-
ключено, що ушкодження бар'єру слизової шлунково-кишкового такту може
призвести до ендотоксемії без розвитку бактеріемії.
Токсичний вплив LPS ендотоксину проявляється комплексом порушень,
які обумовлені одночасним ушкодженням як циркулюючих у крові клітин, так
і ендотеліоцитів, що призводить до розвитку поліорганної недостатності.
Слід зазначити, що вказані ефекти опосередковуються ендотоксинами
лише в умовах їх надмірно високої концентрації в крові. При звичайних умо-
вах мікробні продукти, навпаки, підвищують ефективність імунних реакцій,
тому що специфічно розпізнаються імунокомпетентними клітинами. Зокрема,
ендотоксини посилюють хелперну функцію Т-клітин, стимулюють В-лімфо-
цити і плазматичні клітини, прискорюють утворення нових імуноцитів.
Серед численних метаболічних зрушень, опосередкованих дією цитокінів,
особливої уваги заслуговує так званий оксирадикальний стрес. Саме з роз-
витком оксирадикального стресу здебільшого і пов'язане аутопошкодження
при сепсисі і ССЗВ іншого генезу. При адекватній імунній відповіді подібний
процес відбувається у фаголізосомах макрофагів і нейтрофілів і називається
"кисневим вибухом" (див. "Структура і функціональне призначення окремих
компонентів природженого імунітету"). Виникнення оксирадикального стресу
при сепсисі пов'язано з генералізованою активацією макрофагів, які продуку-
ють велику кількість вільних радикалів до позаклітинної рідини для деструк-
ції патогену. При сепсисі порушується рівновага між про- і антиоксидантни-
ми механізмами фагоцитів, що й обумовлює вивільнення величезної кількості
вільних радикалів і перекисів. При цьому за рахунок впливу вільнорадикальних агентів відбувається денатурація екстраклітинних ферментів та інших
біологічно важливих протеїнів, що супроводжується втратою їх функціональ-
ної активності і підвищенням чутливості до протеолізу. З іншого боку, ініці-
юється процес перекисного окислення ліпідів мембран, що призводить до
порушення цілісності зовнішніх покривів клітин. При цьому вільні радикали
одержують доступ до інтрацелюлярного середовища, де ушкоджують найваж-
ливіші внутрішньоклітинні ензими - каталази, NADF-дегідрогенази, NADF-
оксигенази й інші з наступним порушенням функціонування дихального лан-
цюга мітохондрій і блокадою синтезу АТФ.
Посилення продукції оксирадикалів викликає нагромадження речовин, які
інактивують натуральні продукти синтезу ендотеліальних клітин, нейронів,
тромбоцитів, клітин ендокарда і міокарда, сприяючи розвитку неадекватної
мікроциркуляції. Вільні радикали і гіпохлорна кислота безпосередньо ушко-
джують клітини ендотелію різних органів, що і призводить до формування по-
ліорганної недостатності. Обумовлено це насамперед порушенням нормально-
го кровообігу, який стає недостатнім у зв'язку з одномоментною синергічною
дією ліпідного простацикліну (Pgl2), що викликає вазодилатацію і підтримує
тромборезистентність крові, а також вільнорадикального оксиду азоту (NO),
що забезпечує потужний судинорозширювальний ефект. Вивільнення зазначе-
них речовин є реакцією ендотелію на дію цитокінів і пряме ушкодження під
впливом вільних радикалів.
Відомо, що N0 є найбільш стабільним з вільних радикалів, що постійно
синтезується в судинному ендотелії багатьох органів для забезпечення адек-
ватної тканинної перфузії і рівня локального артеріального тиску. Також оксид
азоту захищає міокард від аритмії, легені від гіпоксії і токсичної дії тромбок-
сану А2, у нирках підтримує клубочковий кровообіг і нормальне виділення
реніну, а в печінці забезпечує нормальний синтез білків коагуляції. Крім того,
N0 забезпечує стійкість судинних стінок до запалення і регулює виділення
гістаміну опасистими клітинами. В умовах сепсису генералізоване вивільнен-
ня оксиду азоту призводить до розвитку артеріальної гіпотензії і порушення
перфузії органів і тканин.
Під впливом ліпіду А ендотоксину порушується цілісність мембран ери-
троцитів, еозинофілів, нейтрофілів, макрофагів, лімфоцитів, унаслідок чого
відбувається вивільнення у кров низки біологічно активних речовин - цитокі-
нів (ФНП-Р і ФНП-а), інтерлейкінів (ІЛ-1, ІЛ-2, ІЛ-6 й інших). Фактор некрозу
пухлини а - ініціатор вивільнення фосфоліпаз, продукції N0, інгібування ан-
гіотензину II, що призводить до порушення систолічної і діастолічної функцій
серця і розвитку артеріальної гіпотензії.
Надмірна системна активація макрофагальних цитокінів надзвичайно
шкідлива, оскільки стимулює синтез додаткових природних медіаторів запалення - лейкотрієнів (LTC4, LTD4, LTE4), інтерлейкінів, гістаміну, брадикініну.
Усі вони беруть участь у порушенні мікроциркуляції і формуванні набряків
шляхом підвищення проникності біологічних мембран і збільшення гідроста-
тичного тиску в капілярах через активацію вазодилатації.
Поряд з цим підвищується вміст клітинного кальцію, прискорюється ката-
болізм білка в скелетних м'язах, посилюється розпад глюкози, наростає аци-
доз, підвищується концентрація гострофазових протеїнів.
Деякі цитокіни наділені властивостями ендогенних пірогенів, відповідаль-
них за розвиток типового для сепсису і ССЗВ гіпертермічного синдрому. Так,
наприклад, при активації моноцитів до кровообігу надходить ІЛ-ір, який про-
никає через гематоенцефалічний бар'єр до нейронів передоптичної ділянки
гіпоталамуса і таким чином стимулює теплопродукцію, а також порушує про-
цеси поведінки. Подібними властивостями наділений і ФНП-а.
Хоча тонкий механізм ураження гепатоцитів і синусоїдальних клітин печін-
ки під впливом цитокінів дотепер невідомий, установлено, що ФНП-а у поєд-
нанні з ІЛ-6 у високих концентраціях здатен чинити пряму гепатотоксичну дію.
Головний механізм пошкодження ендотелію канальців нирок під впливом
ФНП-а, лейкотрієнів і LPS мікробів полягає в локальних змінах фібринолітич-
ної активності крові та ушкодженні ендотелію з його наступним набуханням.
Зазначені речовини також призводять до збільшення кількості ендотеліальних
лізосом, агресивні ферменти яких атакують мембрани, що викликає формування
вогнищ деструкції з наступним відкладанням фібрину в місцях ушкодження.
Таким чином, головною мішенню дії ендотоксину і ФНП-а є ендотеліальні
клітини судин. Активація останніх призводить до вивільнення простацикліну
(Pgl2), виділення еластази, токсичних метаболітів кисню (вільних радикалів),
фактора активації тромбоцитів (ТАФ) і комплементу з вивільненням анафі-
латоксинів (СЗа, С4а, С5а) і мембранатакуючого комплексу. Анафілатоксини
призводять до генералізованої дегрануляції опасистих клітин і вивільнення
гістаміну. Останній у поєднанні з брадикініном, вивільненим внаслідок акти-
вації калікреїн-кінінової системи, призводить до формування синдрому під-
вищеної проникності капілярів (англ. Capillare leak syndrom [CLS]).
Вивільнення субендотеліального колагену при загибелі ендотеліоцитів
супроводжується активізацією кініногену з високою молекулярною масою і
подальшим розгортанням каскаду зсідання крові. Зазначені процеси відбува-
ються на тлі адгезії тромбоцитів до вільних колагенових волокон за посеред-
ництвом фактора Віллебранда. При цьому з активованих тромбоцитів виділя-
ється тромбоксан А2 (ТрА2), який викликає подальше зменшення тромборе-
зистентності крові. У той же час зазначений фактор збільшує виразність CLS
шляхом збільшення гідростатичної капілярної гіпертензії і набряку тканин,
оскільки вазоконстрикція, індукована ТрА2, відбувається на тлі прогресуючого
збільшення проникності стінок судин, що викликано дією лейкотрієнів, гіста-
міну і брадикініну.
Таким чином, тяжкість порушення мікроциркуляції і формування мно-
жинної недостатності органів при сепсисі і ССЗВ іншого генезу залежить від
поєднаного ушкодження під дією цитокінів, системи гемостазу й імунітету.
Так, активація коагуляції й агрегації тромбоцитів супроводжується розвитком
тромбоцитопенії, появою продуктів деградації фібриногену і білка фібронек-
тину, який є ключовим модулятором імунної відповіді за рахунок забезпечен-
ня бактеріальної опсонізації, активації Т-лімфоцитів і процесів зсідання крові.
При цьому відбувається виснаження білків-антикоагулянтів і підвищення рів-
ня протеїнів-прокоагулянтів.
За присутності тромбопластину, який надходить у кров з ушкоджених тка-
нин, на тлі порушених функцій ендотеліоцитів активація коагуляції крові при-
зводить до блокування капілярної циркуляції, що лежить в основі поліорганної
недостатності при сепсисі.
Імунопараліч - своєрідна реакція імунокомпетентних клітин на масив-
ну інфекцію і різноманітні екстремальні впливи. Проявляється імунопараліч
Т-клітинною дисфункцією - неповноцінною проліферацією Т-лімфоцитів під
впливом надмірної антигенної або цитокінової (ІЛ-2 і ІФН-у) стимуляції.
Таким чином, ССЗВ - це надмірна запальна реакція, при якій у результа-
ті вивільнення надвисоких доз прозапальних цитокінів відбувається розвиток
поліорганної недостатності. Однак багато питань у цій сфері залишаються усе
ще не з'ясованими. Що визначає підвищення концентрації цитокінів? Яка фі-
зіологічна система здатна усунути їх вивільнення або змінити регуляцію їх
вивільнення?
Таблиця 60.
Дата добавления: 2016-08-07; просмотров: 633;
