в історичному аспекті 20 страница
рункули, карбункули, парапроктити, абсцеси, стафіло- і стрептодермії, піурії
нез'ясованого генезу, остеомієліт, сепсис, однак у структурі смертності саме
їм належить перше місце.
Усі хворі з хронічною або рецидивною лихоманкою нез'ясованого генезу
мають бути проконсультовані у клінічного імунолога. Особливу увагу слід при-
ділити персистуючій пліснявці та іншим грибковим ураженням шкіри, слизо-
вих оболонок і внутрішніх органів. В умовах ІДЗ може траплятися грибковий
сепсис, вкрай резистентний до лікування традиційними засобами.
Про наявність імунних порушень красномовно свідчить стан лімфоїдних
органів пацієнта. Лімфаденопатія з ранньою декомпенсацією (тонзилекто-
мія, апендектомія), стійкий гепатолієнальний синдром нез'ясованого генезу є
типовими ознаками хвороб імунної системи. Особливу групу хворих на ІДЗ
складають особи після спленектомій (наприклад, після травматичного розриву
селезінки), у яких формується стійкий імунний дефект, досить резистентний
до терапії імунотропними засобами. При обстеженні імунологічно скомпроме-
тованих хворих клінічний імунолог може зустрічатися з гіпер- або гіпоплазією
тимусу, гіпо- або аплазією лімфоїдної тканини, які, особливо під час запаль-
них процесів, можуть бути надійними ознаками ІДЗ.
Іноді важливим для постановки діагнозу є не самі клінічні прояви хворо-
би, а чутливість захворювання до певного лікування. Необхідність у тривало-
му використанні антибіотиків для лікування інфекції (до 2-х місяців і більше),
а також потреба у їх внутрішньовенному введенні можуть свідчити на користь
хвороби імунної системи.
Анамнестичні дані. Для адекватної оцінки імунного статусу необхідно
з'ясувати деякі дані щодо перебігу пологів та особливостей постнатального
розвитку. Всі виявлені клінічні ознаки на момент огляду необхідно інтерпре-
тувати в світлі зібраних анамнестичних даних. Оскільки методика збору анам-
незу в імунології не охоплює всі питання щодо стану здоров'я особи, а лише
забезпечує збір імунологічно орієнтованих даних, запропоновано називати та-
кий анамнез імунологічним.
Антенатальний імунологічний анамнез має включати питання щодо пе-
ренесених вірусних і бактеріальних захворювань матері протягом першого
триместру вагітності, щодо застосування протягом вагітності медикаментів
(зокрема, препаратів глюкокортикоїдів і статевих гормонів, деяких антибіоти-
ків, сульфаніламідів, антигістамінних і нестероїдних протизапальних засобів),
які чинять імуносупресивну дію. Слід з'ясувати, чи не перебувала вагітна під
впливом несприятливих екологічних факторів, шкідливих чинників виробни-
цтва і побуту. Окремо необхідно зупинитися на перенесених гестозах першої
половини вагітності (у термін, коли відбувається закладка і особливо активне
становлення органів імунної системи) і загрозах переривання вагітності у ран-
ні терміни, що супроводжуються тривалим застосуванням прогестинів.
Слід встановити, чи були порушення у харчуванні вагітної, чи мали місце
загострення хронічних захворювань матері під час вагітності, чи супроводжу-
валась вагітність значними стресовими навантаженнями. Неабияке значення
має патологічний перебіг пологів, оскільки він відбивається на функціонуван-
ні імунної системи протягом перших днів життя, коли вона надзвичайно чут-
лива до дії несприятливих чинників.
При збиранні анамнезу життя слід звернути увагу на факт виникнення
захворювань з раннього віку, ранню появу рецидивних інфекцій: бронхоле-
геневих (бронхіти, пневмонії), гнійних отитів, синуїтів, діареї, екземи, фу-
рункульозу, абсцесів, герпетичної висипки, остеомієліту, піурії нез'ясованої
етіології, що може свідчити про спадковий або природжений характер ІДЗ.
Цінну інформацію можуть надати дані про тяжкість та маніфестність захво-
рювань, тривалий субфебрилітет, схильність до генералізованих процесів та
реакцій, неефективність застосування традиційної терапії, що може свідчити
про скомпрометованість імунної системи. До уваги слід брати факти розвитку
аутоімунних та неопластичних захворювань, побічні реакції на вакцинацію,
алергійні реакції на медикаменти і алергійні захворювання, в основі яких, без
сумніву, лежать імунопатологічні процеси. Цінну інформацію про генез на-
явних імунних розладів можуть надати дані про тривале застосування хворим
глюкокортикоїдів, цитостатиків, сульфаніламідів, антигістамінних препаратів,
особливо у ранньому дитячому віці.
Генеалогічні дані. За рахунок генеалогічних даних можна з'ясувати спад-
ковий характер наявного ІДЗ або спадкову схильність до розвитку захворювань
імунної системи. Схема генеалогічного дерева (схема 6), яка застосовується в
клінічній імунології, відрізняється від класичної, що використовується в гене-
тиці. Класичне медичне генеалогічне дерево передбачає з'ясування характеру
спадкування (аутосомно-домінантний, аутосомно-рецесивний, зчеплений зі
статтю тощо) певної хвороби, яка є у пробанда. Імунологічне дерево має скри-
нінговий характер і з'ясовує не характер спадкування певної патології, а факт
наявності у родичів пробанда в кількох найближчих поколіннях певних станів і
хвороб, в основі розвитку яких провідну роль відіграють імунологічні розлади.
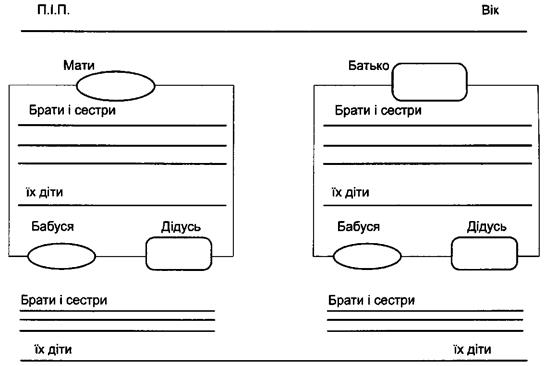
Схема 6. Схема родоводу у клінічній імунології
Стад здоров'я батькІР
Імунологічний анамнез. Часті інфекційні захворювання у дитинстві, часті випадки
ГРВІ останнім часом; факт видалення аденоїдів, мигдаликів, апендикса; наявність хронічного
тонзиліту і гаймориту, респіраторних захворювань (бронхіти, пневмонії, бронхоектази), сер-
цево-судинних захворювань (ІХС, артеріальна гіпертензія, міокардит, ревматизм), психічних
захворювань, захворювань органів травлення (гастрит, виразка, холецистит, ЖКХ, панкреа-
тит, гепатит); захворювань нирок (пієлонефрит, СКХ, гломерулонефрит), патології системи
крові (анемії, геморагічний синдром); ендокринопатій (цукровий діабет, патологія щитовид-
ної залози), туберкульозу, мігрені; наявність онкологічних захворювань, патології статевої
сфери, автоімунних хвороб, шкідливих звичок (паління, алкоголізм) та шкідливостей ви-
робництва; випадки мертвонародження або смерті дитини у ранньому віці.
Алергологічний анамнез. Наявність алергічних захворювань: дерматит, екзема, брон-
хіальна астма, поліноз, кропивниця, набряк Квінке, харчова алергія; побічні реакції на певні
ліки, харчові інгредієнти та побутові речовини.
Лабораторні дані. При проведенні загального аналізу крові про наявність
ІДЗ може свідчити лімфопенія (кількість лімфоцитів менше 1,0х 109/л) або немо-
тивований лімфоцитоз, нейтропенія, тяжка гемолітична або апластична анемія,
тромбоцитопенія, еозинопенія, сповільнена ШОЕ при бактеріальних інфекціях.
Із біохімічних аналізів слід звернути увагу на наявність гіпоглобулінемії, осо-
бливо за рахунок у-фракції, до якої, як відомо, належать антитіла (імуноглобуліни). Оскільки активовані імунокомпетентні клітини і фагоцити синтезують
цитокіни, що регулюють проліферацію і дозрівання клітин крові у червоному
кістковому мозку (ІЛ-1Р, ГМ-КСФ, М-КСФ, Г-КСФ та інші), всі хворі з лейке-
моїдними реакціями мають бути проконсультовані клінічним імунологом.
Дані імунограми (див. "Принципи інтерпретації даних імунограми у
практиці клінічного імунолога").
§2. Лабораторні методи оцінки імунного статусу
1. Діагностичні рівні лабораторної
оцінки імунного статусу
Згідно з сучасними уявленнями, імунна система виконує не тільки уні-
кальну функцію імунітету, але і виступає в ролі однієї з інтеграційних систем
в організмі, яка посередництвом цитокінів забезпечує зв'язок між нервовою і
ендокринною системами.
Лабораторна діагностика є однією з найважливіших методичних основ
клінічної імунології, за допомогою якої дають характеристику окремим лан-
кам імунної системи і оцінюють їх функціональний стан. Індивідуальна оцінка
імунного статусу дитини - одна з важливих і складних проблем дитячої клініч-
ної імунології.
Для об'єктивної оцінки стану імунної системи людини введено поняття
імунного статусу. Імунний статус - це сукупність кількісних і функціональних
показників, які відображають стан імунної системи людини на даний час.
Оцінку імунного статусу проводять для:
1) повної оцінки стану здоров'я;
2) виявлення дисфункцій імунної системи;
3) виявлення різних захворювань, у патогенезі яких можлива участь імунних
порушень;
4) виявлення генетично обумовлених дефектів імунної системи;
5) контролю дії "факторів шкідливості";
6) вивчення стану до і після вакцинації в групах ризику;
7) контролю імуномодулювальної, імуносупресивної і цитостатичної терапії; .
8) вивчення гострих і хронічних інфекцій різної етіології, в тому числі СНІДу
9) вивчення аутоімунних, імунокомплексних, алергійних хвороб;
10) вивчення лімфопроліферативних у інших злоякісних новоутворень;
11) для обстеження реципієнтів до і після трансплантації органів.
Сьогодні відома велика кількість методів оцінки окремих ланок імунної
системи. Це дозволяє практикуючому лікарю-імунологу вибрати найбільш
адекватні з відомих методів для конкретних діагностичних і прогностичних
цілей. Загальновизнаною в класичній імунології залишається двоетапна сис-
тема оцінки імунного статусу людини (Петров Р. В., Лопухін Ю. М., Чередєєв
А. Н. та ін., 1984). Згідно з цією системою всі існуючі на даний час імуноло-
гічні дослідження поділяють на тести І і II рівня.
Тести І рівня - орієнтуючі. За допомогою тестів першого рівня можна ви-
явити грубі дефекти в клітинній і гуморальній ланці імунітету, а також в сис-
темі фагоцитів. До них належать:
1) визначення відносного і абсолютного числа лімфоцитів у периферійній
крові (лейкограма);
2) визначення відносної і абсолютної кількості Т- і В-лімфоцитів;
3) визначення концентрації основних класів сироваткових імуноглобулінів
(IgA, IgM, IgG);
4) визначення фагоцитарної активності лейкоцитів;
5) визначення титру комплементу.
Зазначені методи здебільшого доступні лабораторіям клінічної імунології.
Використання цих тестів у повсякденній практиці клінічного імунолога дає
можливість підтвердити або спростувати припущення про порушення функці-
онування імунної системи.
Тести II рівня - аналітичні. Аналітичні тести рекомендується викорис-
товувати для поглибленого аналізу стану імунної системи, визначення рівня і
складності порушень в імунній системі. Ці тести доступні лише добре осна-
щеним спеціалізованим імунологічним лабораторіям. До них відносяться:
1) визначення основних популяцій лімфоцитів і субпопуляцій регуляторних
Т-лімфоцитів за допомогою моноклональних антитіл;
2) тест гальмування міграції лейкоцитів;
3) оцінка проліферативної активності Т- і В-лімфоцитів на мітогени, антиге-
ни, алогенні клітини (РБТЛ);
4) оцінка активності природних кілерів;
5) виявлення циркулюючих імунних комплексів (ЦІК);
6) визначення рівня різних компонентів комплементу;
7) оцінка різних етапів фагоцитозу і рецепторного апарату фагоцитів;
8) тести на визначення медіаторів імунної системи, в тому числі продукції і
рецепції інтерлейкінів;
9) аналіз генів, відповідальних за експресію імунологічно значущих молекул;
10) визначення рівнів специфічних IgE;
11) НСТ-тест;
12) інші дослідження стану імунної системи.
В клінічній імунології, на наш погляд, доцільніше виділяти три рівні діа-
гностичного пошуку (скринінговий, розширена імунограма, оцінка ефекторної
ланки), які представлені у параграфі, присвяченому принципам інтерпретації
імунограми.
2. Лабораторні методи дослідження лімфоцитів
Дослідження лімфоцитів у лабораторії, як правило, включають етап виді-
лення фракції мононуклеарних лейкоцитів із периферійної крові. З цією метою
використовують метод градієнтного центрифугування. Кров хворого беруть із
вени в розчин гепарину, розводять у 2 рази буферним ізотонічним розчином
хлориду натрію, який не містить іонів Mg** і Са"14", і обережно нашаровують на
розчин фіколу. В останній для збільшення його щільності додають рентгенкон-
трастний препарат для внутрішньовенного введення (наприклад, верографін,
гіпак, тріозил та ін.). Внаслідок цього між плазмою і розчином фіколу утворю-
ється ступінчастий градієнт щільності. Після центрифугування еритроцити і
гранулоцити проходять через фікол і осідають на дно, а мононуклеари (лімфо-
цити і моноцити) залишаються у вигляді кільця в інтерфазі. Клітини збирають
піпеткою, відмивають, переносять в культуральне середовище і досліджують
за допомогою різних методів.
Всі методи дослідження лімфоцитів можна розділити на вивчення поверх-
невих маркерів і постановку функціональних тестів. У 1983 році Перша між-
народна робоча нарада з питань щодо антигенів диференціювання лейкоцитів
запровадила в практику клінічної імунології термін "clusters of differentiation"
(кластери диференціювання, скорочено CD), а в 1989 році Четверта нарада
прийняла їх робочу номенклатуру (таблиця 21). Сьогодні нараховується біль-
ше 250 CD маркерів.

Таблиця 21.

Кількісні методи, основані на виявленні поверхневих маркерів лімфо-
цитів. Сьогодні для ідентифікації поверхневих структур лімфоцитів і деяких
інших клітин використовують 3 групи методів:
- методи розеткоутворення;
- методи імунофлюоресценції;
- імуноферментні методи.
Най дешевшим і в той же час достатньо точним методом визначення чи-
сельності популяції Т-лімфоцитів є метод розеткоутворення. Метод ґрунтуєть-
ся на наявності спорідненості між рецептором CD2 і глікопротеїнами мембра-
ни еритроцитів барана. Рецептори до еритроцитів барана експресуються вже
на ранніх стадіях диференціювання і не втрачаються при затримці диферен-
ціювання і дозрівання Т-клітин. При змішуванні лімфоцитів з еритроцитами
барана утворюються фігури, які отримали назву розеток. Кількість таких роз-
еткоутворюючих клітин (Е-РУК) відповідає кількості Т-лімфоцитів, для яких
характерна експресія на поверхні CD2 антигену. Останнім часом з'явилися
дані, що розеткоутворення забезпечується не тільки зазначеною взаємодією,
а і за рахунок експресії інших адгезійних молекул на поверхні Т-лімфоцитів і
еритроцитів.
Друга модифікація методу розеткоутворення (ЕАС-розетки) використо-
вується для ідентифікації В-клітин. Відомо, що на поверхні В-лімфоцитів є
рецептор для СЗЬ компонента комплементу. Для виявлення цього рецептора
лімфоцити змішують з еритроцитами барана, послідовно обробленими анти-
еритроцитарними антитілами в субаглютинуючій концентрації і комплемен-
том (свіжозамороженою сироваткою крові миші). Використання такого джере-
ла комплементу гарантує захист еритроцитів від комплементзалежного лізису.
Після спільної інкубації В-лімфоцити утворюють фігури розеток.
Розроблена мікромодифікація методу, яка дозволяє зменшити об'єм крові,
необхідний для постановки реакції, до 0,1-0,2 мл і таким чином виключити
забір крові з вени.
Більш прогресивним є використання методу імунофлюоресценції, який
дозволяє за допомогою наборів моноклональних антитіл до різних CD-анти-
генів ідентифікувати практично будь-які поверхневі структури лімфоцитів.
Розрізняють методи прямої і непрямої імунофлюоресценції. Перший поля-
гає у використанні анти-СО-моноклональних антитіл, до яких приєднана флю-
оресцентна мітка. Частіше використовують флюоресцеїн ізотіоціанат (ФІТЦ),
який в ультрафіолетових променях дає зеленкувате світіння. В люмінесцент-
ному мікроскопі (при спостереженні клітин, які оброблені міченими антитіла-
ми) можна побачити характерні вінчики, що світяться. Останні вказують на те,
що на поверхні даної клітини експресовані відповідні диференційні антиге-
ни. Метод непрямої імунофлюоресценції передбачає використання немічених
моноклональних антитіл. Візуалізація реакції здійснюється за допомогою ін-
ших антитіл, які несуть флюоресцентну мітку (наприклад, антитіл кози проти
імуноглобуліну миші, якщо моноклональні антитіла були отримані на основі
мишачої гібрид оми).
Застосування імуноферментного методу, коли до антитіл замість ФІТЦ
приєднується пероксидазна мітка, особливо зручне в невеликих імунологіч-
них лабораторіях, оскільки при цьому не потрібні люмінесцентні мікроскопи.
Кольорову реакцію, яка виникає в умовах взаємодії "субстрат-фермент", мож-
на спостерігати за допомогою звичайного світлового мікроскопа.
Універсальним методом дослідження лейкоцитів є метод лазерної проточ-
ної цитофлюорометрії, який дозволяє не тільки отримати детальні характе-
ристики клітинних субпопуляцій, але й провести їх препаративне розділення.
Перш за все, виходячи із аналізу світлорозсіювання (без використання анти-
тіл) в досліджуваному зразку можна визначити вміст лімфоцитів, моноцитів і
гранулоцитів. Використовуючи метод імунофлюоресценції (прямий або непря-
мий), можна визначити чисельність різних субпопуляцій лімфоцитів. Окрім
реєстрації світіння, можлива оцінка його інтенсивності. Обробка отриманих
даних за спеціальною програмою дає можливість визначити кількість сайтів
зв'язування, тобто вирахувати щільність даного рецептора на клітинній мемб-
рані. За обмежений відрізок часу можна зробити велику кількість аналізів.
На схемі 7 в наочній формі показано, як виявляються різні диференційні
антигени на поверхні лімфоїдних клітин.
Не існує єдиного досконалого способу оцінки кількості лімфоцитів з супре-
сорною або хелперною активністю, оскільки частина CD8+ Т-клітин є кілерами,
а частина СБ4+~ефекторами. У зв'язку з цим оцінку чисельності субпопуляцій
лімфоцитів бажано доповнити функціональними тестами. Найбільш надій-
ний критерій дефіциту Т-клітинної ланки - зниження кількості CD5+ Т-клітин.
Функціонально зрілі Т-лімфоцити експресують CD3, CD5, CD7 антигени.
| CD | В-лф | Т-хелпери | Цитотоксичні Т-лф | ПК |
CD2 _________________________________________ __________
CD3 _________________________________________
CD5________________________________________________
CD6________________________________________________
CD4 ___________________
CD8 _________________________________
CD19 __________
CD20 __________
CD16 _________________________________
CD56 _________________________________
Схема 7. Диференційні антигени імунокомпетентних клітин людини, які ви-
значаються за допомогою моноклональних антитіл в системі CD
Дослідження функціональної активності лімфоцитів. Існує велика
кількість методів, які дають можливість дослідити in vitro різні функції імуно-
компетентних клітин. У клінічних імунологічних лабораторіях досліджують
інтенсивність проліферативної відповіді лімфоцитів на Т- та В-клітинні міто-
гени, продукцію антитіл, а також синтез мононуклеарами периферійної крові
деяких цитокінів.
1. Реакція бласттрансформаціі лімфоцитів (РБТЛ). Відомі речовини,
яким властива мітогенна дія на лімфоцити ссавців. Для оцінки функціонально-
го стану Т-лімфоцитів у клінічній лабораторній практиці використовують фі
тогемаглютинін (ФГА) - рослинний лектин, який отримують із насіння квасолі
або ConA, LPS, до В-лімфоцитів. Для дослідження проліферативної активнос-
ті В-лімфоцитів в якості мітогену застосовують ліпополісахариди бактерій.
Використовують нерозведену нативну кров, яку набирають в стерильних умо-
вах у пробірку з гепарином. Можна використовувати мононуклеарні лейкоци-
ти, виділені з периферійної крові в стерильних умовах методом градієнтного
центрифугування, які в подальшому культивують за присутності ФГА протя-
гом 72 годин. Результати реакції можна обчислювати морфологічним методом
або з використанням радіоактивної мітки.
У першому випадку з клітинної культури готують мазки, фіксують їх в ме-
танолі і фарбують за Романовським - Гімзою як звичайні мазки крові. В світло-
вому мікроскопі з імерсійною системою визначають відсотковий вміст бластів
і перехідних форм по відношенню до загальної кількості лімфоцитів. Результат
може бути поданий також у вигляді індексу стимуляції (ІС), який є відношен-
ням відсоткового вмісту трансформованих клітин в досліді (культура з ФГА) до
відсоткового вмісту трансформованих клітин в контролі (культура без ФГА).
Клінічне значення РБТЛ. При оцінці результатів РБТЛ слід звертати ува-
гу як на інтенсивність проліферативної відповіді стимульованої культури, так
і на висоту відповіді в контрольних пробах. Зниження проліферативної відпо-
віді на ФГА свідчить про наявність імунодефіциту, але механізми останнього
можуть бути різними.
Низька відповідь в РБТЛ може корелювати із дефіцитом Т-клітин в пери-
ферійній крові або із зміною імунорегуляторного індексу (CD4/CD8) на ко-
ристь цитотоксичних Т-лімфоцитів. У деяких випадках (наприклад, в період
відновлення після опромінення або інтенсивної хіміотерапії) низька відповідь
на Т-клітинні мітогени може бути пов'язана з виходом до периферійної крові
великої кількості незрілих Т-клітин. Низька відповідь в РБТЛ може бути обу-
мовлена порушенням продукції таких лімфокінів як, ІЛ-1 й ІЛ-2. При актива-
ції Т-клітин (у випадку інфекції або наявності аутоімунних реакцій) можли-
ве підвищення спонтанної проліферації (висоти проліферативної відповіді в
контрольних пробах).
2. Оцінка інтенсивності продукції цитокінів. За допомогою тестів цієї
групи можна отримати уявлення щодо продукції цитокінів мононуклеарними
лейкоцитами периферійної крові. Слід мати на увазі, що одні цитокіни про-
дукуються переважно лімфоцитами (ІЛ-2, ІЛ-6), а інші - моноцитами (ІЛ-1,
ФНП-а). Продукцію перших стимулюють Т-клітинні мітогени (ФГА, Кон А),
продукцію інших - мікробні ліпополісахариди (ЛПС).
Дослідження проводять за такою схемою. Мононуклеари периферійної
крові, виділені методом градієнтного центрифугування, культивують у 24-ямкових культуральних планшетах (об'єм ямки - близько 2 мл) протягом 16-18
годин за присутності Кон А, ФГА або ЛПС. Надосадову рідину збирають і ви-
значають у ній вміст цитокіну, використовуючи або імуноферментний аналіз,
або цитокінзалежні клітинні лінії.
У продажу є імуноферментні набори для визначення таких цитокінів як
ІЛ-1, ІЛ-2, ІЛ-4, ІЛ-6, ІЛ-10, ФНП-а, ІФН-у. На жаль, такі набори поки що
дуже дорогі. Існує колекція цитокінзалежних клітинних ліній, за допомогою
яких також можна визначити вміст цитокінів у біологічних рідинах і культу-
ральному середовищі. У більшості випадків принцип визначення оснований
на тому, що клітинна лінія здатна розмножуватись тільки за присутності пев-
ного цитокіну, наприклад ІЛ-2 (лінія CTLL-2) або ІЛ-6 (D6C8). Інтенсивність
проліферації клітин ліній (при різних розведеннях досліджуваного зразку) по-
рівнюють з інтенсивністю проліферації клітин тієї ж лінії за присутності різ-
них розведень рекомбінантного цитокіну з відомою активністю. Математичне
порівняння отриманих титрувальних кривих дозволяє вирахувати вміст цито-
кінів у досліджуваному зразку. В деяких випадках (наприклад, при визначенні
рівня ФНП-а) використовують не цитокінзалежну, а цитокінчутливу клітинну
лінію (L929). Клітини цієї лінії гинуть за присутності ФНП-а. Таким чином,
титрувальна крива буде відображати відсоток загиблих клітин, яких буде тим
більше, чим вища концентрація ФНП-а.
3. Оцінка функціонального стану фагоцитів
Найбільш доступним об'єктом для оцінки функціонального стану фагоци-
тів є нейтрофіли крові. Одні тести припускають вивчення цих клітин у цільній
крові, тоді як інші (дослідження рецепторів нейтрофілів, визначення активних
форм кисню) вимагають отримання збагаченої суспензії нейтрофілів. Оцінку
активності Fc і СЗЬ рецепторів нейтрофілів можна проводити за допомогою
реакції розеткоутворення із зимозаном, навантаженим відповідно анти-Fc-aH-
титілами або комплементом при 4 °С. Цей спосіб дозволяє визначити частку
нейтрофілів, здатних до адгезії об'єкту фагоцитозу.
Саму фагоцитарну активність оцінюють за допомогою методів, які дозво-
ляють визначити частку клітин, здатних формувати фагосому (частинки ла-
тексу, еритроцити, тест-культури стафілококу або Е.соїі). Відомий спосіб по-
становки in vitro фагоцитарної реакції з нейтрофілами хворого і виділеними у
нього ж штамами мікроорганізмів. Цей спосіб найбільш адекватний для реаль-
ної оцінки антимікробної активності нейтрофілів даного хворого.
"Переварюючу" здатність нейтрофілів і їх антибактеріальну активність
можна визначити безпосередньо методом фагоцитозу з переваренням тестованого мікроорганізму. Останнім часом значного розповсюдження набули ме-
тоди оцінки активних форм кисню в НСТ-тесті або за допомогою хемолю-
мінесценції. НСТ-тест використовують значно частіше, при цьому існують
експрес-методи, які проводяться з використанням цільної крові. Суть реакції
полягає в тому, що нітросиній тетразолій (НСТ) фарбується в синій колір за
присутності активних форм кисню, а при її відсутності залишається безбарв-
ним. Підрахунок нейтрофілів з гранулами і включеннями синього кольору фор-
мазану дозволяє визначити частку нейтрофілів з активними формами кисню.
Міграційну активність фагоцитів оцінюють в тестах-реакціях гальмуван-
ня міграції лейкоцитів і спрямованого хемотаксису. Ті самі прийоми можна
використовувати і при дослідженні альвеолярних макрофагів, отриманих із
бронхіальних змивів.
4. Основні методи визначення антитіл і антигенів
Методи визначення антитіл і антигенів основані на різних способах реє-
страції їх взаємодії. Умовно їх можна поділити на 3 групи:
- методи, основані на реакції преципітації;
- методи, основані на реакції аглютинації;
- методи, основані на використанні мічених антитіл або антигенів.
Радіальна імунодифузія способом Манчіні. Цей метод відрізняється ви-
щою чутливістю, тому що антисироватка входить до складу агару, в який із лун-
ки дифундує антиген. В міру віддалення від ямки концентрація антигену посту-
пово падає, поки не стає еквівалентною концентрації антитіл в агарі. При цьому
утворюється своєрідне кільце. Чим вища концентрація внесеного антигену, тим
більша діаметр кільця. Якщо в реакції використовується декілька стандартів з
відомою концентрацією антигену, то шляхом порівняння або побудови калібру-
вальної кривої можна проводити кількісне визначення антитіл у зразках.
Метод широко використовується для визначення концентрації імуногло-
булінів, СЗ компонента комплементу, С-реактивного білка, а-фетопротеїну,
трансферину.
Імуноелектрофорез. Імуноелектрофорез є своєрідним поєднанням елек-
Дата добавления: 2016-08-07; просмотров: 492;
