в історичному аспекті 12 страница
острівців. Подібні перехресні властивості мають і Т-хелпери 1 типу.
Клінічні випробовування ефективності препарату ІЛ-10, що має виразні
антизапальні властивості, показали обнадійливі результати при застосуванні у
хворих на псоріаз.
Препарати, що містять моноклональні антитіла до фактора некрозу
пухлини а, що є потужним прозапальним цитокіном, виявилися ефективними
при ревматоїдному артриті та хворобі Крона.
Найбільш радикальним засобом є повна зміна репертуару імунокомпетент-
них клітин, чого намагаються досягнути при трансплантації аутологічних
стовбурових клітин. Трансплантація стовбурових клітин була здійснена у па-
цієнтів з ревматоїдним артритом, псоріазом, системним червоним вовчаком зі
змінним успіхом.
Резюме. Резюме. Основною функцією імунною системи є підтримання
імунної толерантності до власних антигенів, що забезпечується Т- і В-клітин-
ними механізмами. В кожному із зазначених механізмів виділяють центральний
і периферійний компоненти. Розробка ефективних методів корекції порушень
імунної толерантності, які проявляються аутоімунними реакціями і хвороба-
ми, є актуальною, але досі не вирішеною проблемою клінічної імунології.
§3. Основи протибактеріального імунітету
Про механізми протибактеріального імунітету докладно мова йшла в по-
передніх главах, тому тут ми зупинимося лише на його ключових моментах.
Основним механізмом протибактеріального імунітету є фагоцитоз, здій-
снюваний нейтрофілами і макрофагами. Як відомо, нейтрофіли проводять
також секрецію факторів агресії (вільних радикалів, протеолітичних фер-
ментів, антивітамінів, антинутрієнтів) до тканинної рідини для знищення
бактерій, які за різними причинами уникнули фагоцитозу.
Етапи фагоцитозу:
1. Розпізнавання об'єкту фагоцитозу і фіксація на ньому фагоцита.
Механізм подібного розпізнавання неспецифічний і ґрунтується на вза-
ємодії спеціальних мембранних рецепторів фагоцитів з патогензв'язаними
молекулярними шаблонами, які входять до складу поверхневих структур
бактеріальних клітин. Найчастіше як молекулярні шаблони виступають ліпо-
полісахариди, залишки манози і ліпотейхоєві кислоти. При цьому важли-
вим є не сам факт наявності молекул того чи іншого шаблону на поверхні клі-
тини, а щільність їх розподілу на тій ділянці поверхні бактерії, з якою безпосе-
редньо взаємодіє фагоцит. Так, одиничні залишки манози можуть зустрічатися
і на власних клітинах організму, особливо при частковій втраті поверхневих
екрануючих молекул. У той же час на бактеріальних клітинах міститься вели-
чезна кількість залишків манози, що дозволяє фагоциту щільно фіксуватися на
бактерії і створює достатній за силою активаційний сигнал для перебудови ци-
тоскелета в місці фіксації об'єкта і наступної його інтерналізації (поглинан-
ня). Слід зазначити, що навіть при високій щільності експресії молекулярних
шаблонів захоплення об'єктів, опосередковане їх розпізнаванням, у багатьох
випадках є недостатньо ефективним.
Для вирішення цієї проблеми в процесі імунної відповіді для фагоцитів
напрацьовується новий спосіб розпізнавання об'єктів - за допомогою опсоні-
нів-антитіл. Він полягає у синтезі специфічних антитіл до численних і різно-
манітних поверхневих молекул бактеріальних клітин (так званих антигенів).
Синтезовані імуноглобуліни, фіксуючись своїми антигензв'язуючими центрами
на поверхневих молекулах (тобто здійснюючи специфічне розпізнавання), густо
вкривають поверхню бактеріальної клітини, "візуалізуючи" її для фагоцитів.
Здатність до опсонізації обумовлена унікальною структурою антитіл.
Молекула імуноглобулінів має два полюси: на одному з них розташовується
антигензв'язуючий сайт (Fab-фрагмент), специфічний за своєю просторовою
структурою, а на іншому - так звана Fc-ділянка, ідентична у всіх антитіл.
При цьому Fab-фрагмент залучається до взаємодії з антигеном бактеріальної
клітини, а Fc-ділянка молекули виявляється орієнтованою назовні і є цілком
зручною мішенню для розпізнавання фагоцитом, тим більше що останній має
у своєму розпорядженні відповідні рецептори (так звані Fc-рецептори). У та-
кий спосіб антитіла виконують роль своєрідних "адаптерів", трансформуючи
унікальний антигенний спектр патогену в одноманітний набір власних Fc-ді-
лянок, доступний для розпізнавання фагоцитами. Виходячи з фізико-хімічних
міркувань, взаємодія рецепторів фагоцитів з опсонінами більш ефективна,
аніж з молекулярними шаблонами, тому що перші - власні молекули, а дру-
гі - молекули патогену.
Оскільки між опсонінами і рецепторами макрофагів існує визначена комп-
лементарність (просторова і фізико-хімічна взаємовідповідність), сам меха-
нізм фіксації фагоцита на об'єкті фагоцитозу отримав назву зіперного і на-
гадує дію замка-блискавки.
2. Поглинання (інтерналізація) об'єкта фагоцитозу.
Поглинання об'єкта фагоцитозу ініціюється активаційними сигналами, що
надходять усередину фагоцитуючої клітини при взаємодії її рецепторів з опсо-
нінами або молекулярними шаблонами. В основі процесу поглинання лежить
перебудова цитоскелета фагоцита, який, як відомо, визначає форму клітини.
У результаті подібної перебудови відбувається втягування (інвагінація) тієї
ділянки мембрани, на якому фіксований патоген. У такий спосіб останній по-
глинається усе глибше всередину цитоплазми, поки не настане момент, коли
мембрана над ним зімкнеться і він виявиться оточений своєрідним мембранним
мішком, який отримав назву фагоцитарної вакуолі, або фагосоми. Важливо
відзначити, що у фагосомах бактеріальні клітини залишаються цілком життєз-
датними. Зниження рН середовища за рахунок посиленої роботи протонних
насосів, які містяться в мембрані фагосоми, найчастіше призводить лише до
інактивації мікроорганізмів. Для їх повного знищення необхідне надходження
факторів агресії, сконцентрованих в інших органелах, які називаються лізосо-
мами. Подібні механізми складають субстрат наступного етапу фагоцитозу.
3. Злиття фагосом з первинними лізосомами фагоцитів і руйнування
патогену.
Первинними називають лізосоми, які містять фактори агресії, але позбав-
лені об'єкта фагоцитозу. При злитті з фагосомами первинні лізосоми трас-
формуються у фаголізосоми, або вторинні лізосоми. Саме тут за допомогою
як кисень-залежних, так і кисень-незалежних механізмів здійснюється де-
струкція захопленого патогену. До кисень-залежних механізмів мікробіцид-
ності фагоцитів відносять ушкодження патогенів за допомогою супероксида-
ніона, синглетного кисню, гідроксильного аніона, перекису водню, іона
хлору і гіпохлорної кислоти (НСЮ). Слід відзначити, що дія двох останніх
компонентів багато в чому аналогічна дії хлорного вапна (NaCIO). До кисень-
незалежних механізмів відносять ефекти лактоферину, лізоциму, катіонних
білків, катепсинів, дефензинів і протеїназ, що в основному спрямовані на
грампозитивні бактерії і ґрунтуються на ушкодженні клітинної стінки і пору-
шенні деяких важливих метаболічних процесів.
4. Екзоцитоз фрагментів зруйнованого патогену
Коли захоплена бактеріальна клітина виявиться цілком зруйнованою до
дрібних фрагментів, її залишки видаляються з фагоцита шляхом екзоцитозу.
При цьому пептиди деяких антигенів транспортуються на поверхню клітини,
де зв'язуються з молекулами гістосумісності II класу, тобто відбувається під-
готовка до здійснення антигенної презентації, що забезпечує як ініціацію
імунної відповіді, так і її подальше підтримання. У цьому полягає наступність
імунних реакцій, оскільки реалізація механізмів, які первинно ушкоджують
патоген, одночасно є передумовою для включення подальших процесів, спря-
мованих на підвищення якості механізмів протимікробного захисту.
Оскільки фагоцитоз є найбільш ефективним компонентом протибактері-
альної відповіді, захисні механізми, здійснювані бактеріальними клітинами,
в основному спрямовані на дану ланку. Мова йде про різні патоген-опосеред-
ковані реакції, що порушують третій етап фагоцитозу, оскільки це одночасно і
найважливіший, і найбільш уразливий його механізм:
1. Блокада фаголізосомального злиття, що дозволяє мікроорганізму персис-
тувати у фагосомах, які, як відомо, позбавлені факторів агресії. Особливо
ефективно цей механізм здійснюється мікобактеріями.
2. Резистентність до дії лізосомальних ферментів, що досить висока у стафі-
лококів і гонококів.
3. Здатність швидко залишати фагосоми ще до моменту їх злиття з первинни-
ми лізосомами. Цією властивістю наділені шигели і рикетсії.
У протибактеріальному імунітеті, крім фагоцитів, активну участь беруть і
інші фактори природженої резистентності: лізоцим, комплемент, С-реактив-
ний білок, природні антитіла тощо. Порядок залучення тих чи інших факто-
рів визначається властивостями поверхневих структур бактеріальних клітин.
Як відомо, розрізняють грампозитивні і грамнегативні бактерії, які ма-
ють принципові розходження у структурі поверхневих молекул. Грампозитивні
бактерії володіють потужною клітинною стінкою, утвореною тривимірними
ґратками муреїну. У зв'язку з цим вони чутливі до дії лізоциму, який наді-
лений активністю муреїнази - ферменту, що руйнує муреїн. Грамнегативні
бактерії містять порівняно тонку клітинну стінку, представлену двовимірними
ґратками муреїну, які екрановані ліпідвмісною мембраноподібною структу-
рою. Таким чином, лізоцим позбавлений доступу до клітинної стінки грамне-
гативних бактерій, яка, по суті, більш чутлива до його дії, оскільки є одноша-
ровою структурою. У той же час ліпополісахариди мембраноподібного шару
здатні активувати каскад комплементу за альтернативним шляхом. З іншо-
го боку, до поверхневих залишків манози можливе приєднання манозозв'язу-
ючого протеїну, який також наділений здатністю активувати комплемент. У
будь-якому випадку, активація комплементу призводить до формування пато-
логічних nop у екрануючій мембраноподібній структурі і наступних її локаль-
них деструкцій, обумовлених як осмотичними процесами, так і естеразною
активністю самих компонентів комплементу. Через утворені дефекти лізоцим
отримує доступ до клітинної стінки і наносить наступний цитолітичний удар.
У результаті руйнування клітинної стінки оголюється цитолема бактеріаль-
ної клітини, що містить велику кількість фосфорилхоліну і лецитину, до яких
можливе приєднання С-реактивного білка, що активує каскад комплемен-
ту за класичним шляхом. Утворення патологічних nop у мембрані бактерії є
завершальним цитолітичним ударом. Таким чином, грамнегативні бактерії є
більш стійкими до дії факторів природженої резистентності і вимагають здій-
снення досить складних реакцій для своєї нейтралізації.
На прикладі знешкодження грамнегативних бактерій яскраво демонстру-
ються складні механізми взаємодії різних факторів природженої резистент-
ності в процесі здійснення реакцій протибактеріального захисту, а також пе-
редбачається необхідність наявності великої кількості якісно різних факторів.
Роль імунокомпетентних клітин у здійсненні протибактеріального захисту
полягає в синтезі специфічних антитіл (гуморальні реакції, регульовані Т-хел-
перами 2 типу) і армуванні макрофагів у реакціях антитілозалежної клітин-
но-опосередкованої цитотоксичності, для чого необхідне формування спе-
цифічних Т-хелперів 1 типу. Тому імунна відповідь на бактеріальні антигени
реалізується переважно за гуморальним шляхом, але не вичерпується ним.
У той же час на тип імунної відповіді істотно впливають властивості пато-
гену, зокрема, ефективність його протидії фагоцитозу. У випадку незаверше-
ності фагоцитозу бактерії поводяться як внутрішньоклітинні паразити, тому
питома вага клітинних імунних реакцій, регульованих Т-хелперами 1 типу,
зростає. Особливо вона велика при бактеріальних інфекціях, що викликають
розвиток гранулематозного процесу (туберкульоз, лепра, сифіліс та інші).
Можливість розвитку клінічно маніфестної бактеріальної інфекції обу-
мовлена наявністю у бактеріальних агентів факторів агресії. Імунні реакції
прицільно спрямовують ефекторні механізми протибактеріального захисту на
фактори агресії патогену, що значно зменшує вірулентність останнього.
Основні фактори патогенності бактеріальних мікроорганізмів:
1. Адгезини
Адгезини - це поверхневі молекули білкової природи, що забезпечують
прикріплення (адгезію) мікроорганізму до рецепторів епітелію бар'єрних ор-
ганів, тобто сприяють формуванню вхідних воріт інфекції. Секреторні іму-
ноглобуліни класу A (slgA) здатні специфічно зв'язувати саме ті поверхневі
молекули бактерій, які наділені властивостями адгезинів, що сприяє усуненню
вхідних воріт інфекції. Крім того, рецептори на поверхні епітеліальних клітин
містяться в обмеженій кількості, тому збереження нормального біоценозу
бар'єрних органів найчастіше є запорукою надійної профілактики бактеріаль-
них інфекцій.
2. Капсула
Капсула бактеріальних клітин є порівняно тонким поверхневим шаром по-
лісахаридної або поліпептидної природи. Наявність капсули істотно утруднює
початкові етапи розпізнавання бактерій:
а) капсули екранують бактеріальні структури, що активують системи компле-
менту, а також структури, які розпізнаються імунокомпетентними клітинами;
б) гідрофільність капсул утруднює їх поглинання фагоцитами, а сама капсуль-
на речовина захищає бактерію від дії лізосомальних ферментів і токсичних
пероксидів фагоцитуючих клітин;
в) велике значення має легке відділення капсул від поверхні бактерій, у зв'яз-
ку з чим при взаємодії з подібними субстанціями фагоцити виявляються
хибно зв'язаними.
4. Рухливість
Наявність джгутиків обумовлює активну рухливість мікроорганізмів, що за-
безпечує швидке подолання захисних бар'єрів (наприклад, зони низької рН шлун-
кового вмісту) і ефективне проникнення в міжклітинні щілини. Антитіла, спря-
мовані проти антигенів джгутиків, іммобілізують бактеріальні мікроорганізми.
5. Токсини
Розрізняють два типи бактеріальних токсинів: екзотоксини - субстанції,
цілеспрямовано секретовані бактеріями до внутрішнього середовища макро-
організму, і ендотоксини - фрагменти поверхневих структур бактеріальних
клітин переважно ліпополісахаридної природи, що вивільняються при руйну-
ванні мікроорганізмів під впливом факторів імунної агресії.
Екзотоксини виявляють високу імуногенність і викликають утворення
специфічних нейтралізуючих антитіл, іменованих антитоксинами. Особливо
високою біологічною активністю володіють екзотоксини збудників ботулізму,
правця, холери, дифтерії. При зазначених інфекціях для адекватного захисту
необхідний синтез специфічних антитіл як проти антигенів бактеріальних клі-
тин (антибактеріальний імунітет), так і проти антигенів екзотоксинів (анти-
токсичний імунітет).
Бактеріальні ендотоксини виявляють порівняно слабку імуногенну дію, а
імунні сироватки не здатні цілком блокувати їх токсичні ефекти, пов'язані пе-
реважно з генералізованим вивільненням біологічно активних речовин різної
природи. Нейтралізація ендотоксинів відбувається за рахунок діяльності фа-
гоцитів, зокрема макрофагів селезінки і печінки. Ці клітини містять так звані
рецептори до бактеріальних ліпополісахаридів (rLPS), за допомогою яких
вони "виловлюють" циркулюючі ендотоксини з кровоносного русла і розще-
плюють їх до мономерів.
6. Екзоферменти
Здатність бактеріальних клітин секретувати до внутрішнього середовища
організму деякі ферменти (лецитиназу, гіалуронідазу, колагеназу тощо) зна-
чно підвищує їх інвазійні властивості і збільшує швидкість подолання слизо-
вих, сполучнотканинних та інших бар'єрів. Зв'язування екзоферментів зі спе-
цифічними антитілами призводить до інактивації екзоферментів, оскільки в
результаті формування імунного комплексу або безпосередньо блокуються їх
активні центри, або змінюється їх просторова організація у зв'язку зі стерич-
ною перебудовою всієї молекули. У подальшому утворені імунні комплекси
захоплюються фагоцитуючими клітинами.
7. Спори
Деякі бактерії, іменовані бацилами, під дією несприятливих факторів
здатні утворювати спори. У такому стані мікроорганізм може довгостроково
перебувати у зовнішньому середовищі, не виявляючи майже ніяких ознак жит-
тєдіяльності. Класичними прикладами спороутворюючих бактерій є збудники
сибірської виразки і правця. Слід зазначити, що спори є резистентними і до
дії імунних факторів. З іншого боку, розвиток маніфестної інфекції можливий
лише у випадку виходу мікроорганізму зі стану спори у звичайну вегетативну
форму, цілком чутливу до дії факторів імунного захисту.
Таким чином, надійним засобом захисту майже проти усіх факторів агресії
бактерій є специфічні антитіла, що пояснює високу ефективність імуноглобу-
лінотерапії при бактеріальних інфекціях. У зв'язку з важливою роллю фаго-
цитозу ефективними є також імунотропні препарати, що посилюють фагоци-
тарну активність нейтрофілів і макрофагів.
§4. Основи противірусного імунітету
1. Загальні положення
Особливий інтерес до імунології вірусних інфекцій викликаний унікаль-
ною характеристикою біології їх збудників. Вірус - облігатний внутрішньо-
клітинний паразит, який для синтезу своїх білків використовує біохімічний
апарат клітини-хазяїна. До складу вірусу входить нуклеїнова кислота, запако-
вана в білкову структуру, яка називається капсидом (прості віруси). Зазначені
структури можуть оточуватись мембраноподібною оболонкою, або суперкап-
сидом (складні віруси).
Більшість патогенних вірусів проникає в організм людини через слизові
оболонки або потрапляє безпосередньо в кровоносне русло (схема 4). Шкіра і
слизові є основними природними бар'єрами для вірусного вторгнення. До хі-
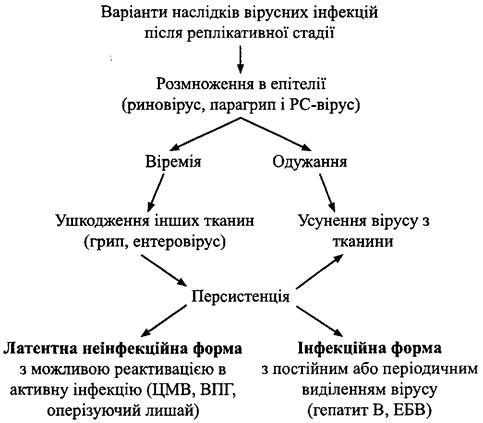
Схема 4. Варіанти наслідків вірусних інфекцій після реплікативної стадії
мічних бар'єрів відносять шлунковий сік і жовч, які швидко знищують чутливі
до них віруси. Після подолання цих бар'єрів вірус розмножується в первинно-
му вогнищі і звідти розповсюджується по всьому організмі, викликаючи ті чи
інші клінічні прояви інфекції. Кінцевий результат хвороби залежить від функ-
ціональної активності захисних механізмів організму, в першу чергу факторів
природженої резистентності.
2. Роль факторів природженого імунітету
Слід зазначити, що організм людини може бути природно резистентним,
природно сприйнятливим або специфічно імунним до розвитку вірусної
інфекції. У природно резистентному організмі виключена можливість роз-
витку навіть одного єдиного циклу репродукції вірусу внаслідок нездатнос-
ті клітин забезпечити проникнення і депротеїнізацію вірусу. Таким чином, не
відбувається звільнення вірусної нуклеїнової кислоти і розмноження вірусу.
Зазначена резистентність пов'язана з відсутністю специфічного клітинного
рецептора для фіксації даного вірусу. Так, відсутність зрілих В-лімфоцитів у
дітей з хворобою Брутона робить неможливим інфікування цих клітин вірусом
Епштейна - Барр; людина несприйнятлива до багатьох вірусних інфекцій тва-
рин. У природно сприйнятливому організмі спочатку не розвивається специ-
фічна імунна відповідь, опосередкована антитілами і Т-лімфоцитами. Основна
роль надається факторам природженої резистентності, а також фізіологічним
реакціям. Так, підвищення температури тіла стимулює вироблення інтерферо-
ну і зупиняє розмноження вірусу. Власне імунні фактори залучаються тільки
на 5-6 добу інфекції. У специфічно імунному організмі головну роль у за-
хисті організму від вірусної інфекції відіграють специфічні Т-лімфоцити та
антитіла (імуноглобуліни класів A, G, М), які залучаються одразу ж після над-
ходження вірусу. При респіраторних та кишкових вірусних інфекціях важли-
вим є місцевий імунітет, а саме - секреторний IgA. Даний імуноглобулін має
підвищену авідність до вірусів і тому здатен попереджувати рецидиви інфекції
біля її вхідних воріт. IgG і IgM беруть участь у нейтралізації вірусів та їх ток-
сичних компонентів у плазмі крові.
Тяжкість перебігу вірусних інфекцій залежить від функціональної актив-
ності факторів природженої резистентності. Відмінності в перебізі вірусних
інфекцій визначаються лише в перші дні, коли ще не працюють власне імунні
механізми (схема 5).
Після проникнення в клітину вірус звільняється від своєї оболонки, ви-
вільняючи нуклеїнову кислоту, яка вбудовується в геном хазяїна або пригнічує
транскрипцію клітинної ДНК, залишаючись у цитоплазмі. В інфікованій клі-
тині відбувається реплікація вірусного геному і збирання нових вірусів. При
цьому на її мембрані з'являються молекули суперкапсиду віруса (патогензв'я-

зані шаблони), що стають доступними для розпізнавання факторами природженої резистентності (антигенпрезентуючими клітинами). Крім того, в якості
молекулярних шаблонів використовуються фрагменти вірусних нуклеїнових
кислот, що вивільняються при загибелі інфікованих клітин. АПК забезпечують
первинне руйнування скомпрометованої клітини і здійснюють презентацію ві-
русних антигенів Т-хелперам, залучаючи імунні механізми. Слід зазначити,
що віруси можуть уражати самі антигенпрезентуючі клітини. В такому разі
інфіковані клітини експресують два типи комплексів - HLA ІІ-імуногенний
пептид та HLAI-імуногенний пептид. За допомогою першого АПК ініціюють
імунну відповідь, а за допомогою другого - спрямовують її ефекторний меха-
нізм на своє руйнування.
Природжений противірусний захист реалізується посередництвом двох
компонентів: гуморального (інтерферони, комплемент) і клітинного (при-
родні кілери і макрофаги).
Гуморальні фактори:
1. ІФН-а і ІФН-Р синтезуються в інфікованій клітині і здійснюють проти-
вірусний захист сусідніх клітин шляхом активації генів з антивірусною актив-
ністю. ІФН-у виконує роль регуляторного цитокіну, активуючи макрофаги і
природні кілери для здійснення реакцій противірусного захисту.
2. Комплемент:
• вірус активує комплемент класичним і альтернативним шляхами;
• комплемент здійснює віроліз (лізис вірусу) в умовах високої щільності екс-
пресії поверхневих антигенів вірусу;
• компоненти комплементу опсонізують вірус перед фагоцитозом;
• комплемент бере участь в реакціях антитілозалежної клітинно-опосередко-
ваної цитотоксично сті.
Клітинні фактори:
1. Природні (натуральні) кілери (ПК) належать до фракції великих грану-
лярних лімфоцитів, які складають 5 % клітин периферійної крові. ПК властива
спонтанна клітинно-опосередкована цитотоксичність щодо вірусінфікованих
клітин. Природні кілери не обмежені молекулами головного комплексу гіс-
тосумісності при розпізнаванні мішеней і можуть руйнувати вірусінфіковані
клітини, які блокують експресію цих молекул. Так, при цитомегаловірусній
(ЦМВ) інфекції ПК є головним ефекторним механізмом захисту.
2. Макрофаги:
- прямий цитотоксичний ефект щодо клітин, заражених РНК-вірусами (крас-
нуха, кліщовий енцефаліт, грип, епідемічний паротит) і ДНК-вірусами (ві-
руси натуральної віспи та контагіозного молюска);
- місце латентної персистенції для збудників з наступною вірусемією й за-
раженням інших клітин;
- місце продукції дочірніх вірусів при ВІЛ-інфекції.
3. Зв'язок природженого і набутого противірусного імунітету
Зв'язок природженого і набутого противірусного імунітету у загальних ри-
сах продемонстровано на рис. 21.
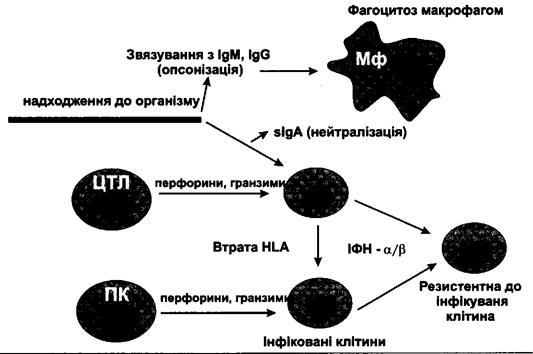
Рис. 21. Принципова схема противірусного імунітету.
На рисунку показано, що у разі проникнення вірусу через слизові оболонки відбувається
зв'язування його віріонів з slgA, що призводить до нейтралізації патогену. Якщо ж вірус до-
лає бар'єр, утворений slgA, і проникає до клітин, останні піддаються атаці з боку специфіч-
них цитотоксичних Т-лімфоцитів. Деякі інфіковані клітини припиняють експресію молекул
HLA І, що є захисним механізмом від Т-кілерів. Однак у такому разі вони стають зручними
мішенями для природних кілерів. При парентеральному проникненні вірусу, останній зв'язу-
ють специфічні IgM й IgG, які виступають у ролі опсонінів. Опсоніни утворених імунних
комплексів розпізнаються макрофагами, які фагоцитують патогени.
4. Чинники набутого противірусного імунітету
1. Гуморальні імунні реакції
Сьогодні розрізняють такі типи противірусних антитіл:
- нейтралізуючі антитіла, які справляють протективний ефект шляхом зв'язу-
вання віріонів з формуванням імунних комплексів;
- блокуючі антитіла (переважно IgA), які попереджують взаємодію збудника
з рецепторами чутливих клітин;
- комплементзв'язуючі антитіла, які беруть участь в комплемент-залежному
цитолізі заражених клітин і руйнуванні вірусних оболонок;
- антитіла реакцій антитілозалежної клітинно-опосередкованої цитотоксич-
ності. Зазначені реакції обумовлені взаємодією антитіл з експресованими
на мембрані клітини вірусними антигенами і реалізуються за участю комп-
лементу і макрофагів.
Несприйнятливість до вірусних інфекцій обумовлена наявністю специфіч-
них антитіл. Вакцинопрофілактика є найефективнішою при збудниках зі ста-
більним антигенним складом і обмеженою кількістю серотипів (віруси кору,
краснухи, вітряної віспи, епідемічного паротиту, гепатиту В).
2. Клітинні імунні реакції
Клітинні імунні реакції є найважливішим механізмом елімінації збудників
вірусної інфекції. При вірусних інфекціях формуються переважно Т-хелпе-
ри першого типу (Th 1). Саме ці клітини починають виконувати регуляторну
роль, координуючи взаємодію, диференціацію і проліферацію усіх клітин, за-
діяних у здійсненні імунної відповіді. Так, антигенспецифічні Th 1 активують
і індукують диференціювання і проліферацію цитотоксичних Т-лімфоцитів, а
завдяки частковому сумісництву функцій Т-хелперів 2 типу сприяють розмно-
женню антитілоутворюючих клітин. Цитотоксичні Т-лімфоцити розпізнають і
знищують клітини-мішені, що містять антигени головного комплексу гістосу-
місності першого класу (HLA І) з вірусними пептидами.
5. Зараження імунокомпетентних клітин
при вірусній інфекції
Найбільш вдалими мішенями для вірусного вторгнення є клітини з інтен-
сивним метаболізмом. Саме цій вимозі відповідають імунокомпетентні кліти-
ни, тому за умови вірусної інфекції часто відбувається зараження самих іму-
нокомпетентних клітин. При цьому слід відзначити, що інфікування вірусами
лімфоцитів або порушення їх функціональних властивостей є основним ме-
ханізмом формування імунної недостатності при вірусних інфекціях. Віруси
можуть уражати як клітини природженої резистентності (макрофаги), так і
лімфоцити (Т- і В-клітини). Так, віруси грипу, простого герпесу, поліомієліту
і кору порушують функціональну активність Т-лімфоцитів, що проявляється
Дата добавления: 2016-08-07; просмотров: 788;
