в історичному аспекті 11 страница
може лише незначним чином відбитися на загальній кількості імунокомпе-
тентних клітин. Крім того, деякі субпопуляції лімфоцитів є відносно малочи-
сельними (наприклад, цитотоксичні Т-лімфоцити), тому їх апоптотична заги-
бель мало впливає на загальну кількість імунокомпетентних клітин. У той же
час, саме ці лімфоцити є ефекторною ланкою імунної відповіді, при нестачі
яких знецінюються всі реалізовані реакції імунітету. Тому надзвичайно важ-
ливо проводити імунологічні дослідження, за рахунок яких у динаміці можна
відслідковувати рівні різних субпопуляцій імунокомпетентних клітин. По-тре-
тє, в умовах масової загибелі лімфоцитів інколи реалізується компенсаторний
механізм, який нівелює лімфопенію. Мова йде при інтенсивне надходження у
циркуляцію так званих "нульових лімфоцитів" (недостатньо диференційова-
них клітин). У такому разі лімфопенія не відзначається, однак імунний дефект
наростає, оскільки О-лімфоцити, будучи функціонально незрілими, не в змозі
адекватно виконувати свої функції. Виявити підвищений вміст О-лімфоцитів
можна за даними методу розеткоутворення.
У зв'язку із зазначеною стадійністю існує можливість "перехоплення" ре-
алізації запрограмованої загибелі на рівні формування підвищеної готовнос-
ті імунокомпетентних клітин до апоптозу. Для цього визначають спеціальні
лабораторні маркери підвищеної готовності лімфоцитів до апоптозу (рівень
клітин, що експресують рецептори CD95, TNF-R,, DR-3, DR-4, DR-5, DR-6 та
деякі інші). Найчастіше проводять визначення одного із найбільш характерних
рецепторів апоптозу - молекули CD95 (Fas). При високій її експресії, особли-
во за умови наявності імунних дефектів, існує суттєва загроза апоптотичної
загибелі лімфоцитів і погіршення стану хворого. Однак найбільш інформатив-
ним щодо діагностики підвищеної готовності імунокомпетентних клітин до
апоптозу є не сам по собі високий рівень експресії відповідних рецепторів, а
зміна інтенсивності їх експресії у одного хворого. Саме тому доцільним є про-
ведення імунологічних досліджень у динаміці.
Як зазначалося вище, при згортанні імунної відповіді відбувається масова
апоптотична загибель імунокомпетентних клітин. Це явище цілком фізіологіч-
не. Патологічним є апоптоз за умови активного, незавершеного інфекційного
процесу. Тому результати імунограми завжди необхідно інтерпретувати у світ-
лі клінічних даних.
Наявність стійкого імунного дефекту є фактором ризику патологічно-
го апоптозу, оскільки у зв'язку зі слабкою імунною відповіддю формується
недостатній захисний фон для відміни апоптозу активованих імунокомпе-
тентних клітин. Призначення імуностимулювальних засобів таким хворим
необхідно проводити вкрай обережно і під ретельним контролем показників
імунограми.
ГЛАВА II. ФУНКЦІЇ ІМУННОЇ СИСТЕМИ
§1. Загальні положення
Ця глава присвячена вивченню функцій, які виконує в організмі імунна систе-
ма. Основними функціями імунної системи є підтримання імунної толерантнос-
ті, здійснення протиінфекційного, протиінвазивного і протипухлинного захисту,
забезпечення формування імунної пам'яті, виконання регуляторних впливів у
інтегральній системі імуно-нейро-ендокринної регуляції функцій організму.
При хворобах імунної системи порушуються ті чи інші функції імунної
системи. Зокрема, при аутоімунних захворюваннях порушується підтриман-
ня імунної толерантності, при імунодефіцитних хворобах - реалізація реакцій
протиінфекційного, протиінвазивного захисту та імунної пам'яті, у разі виник-
нення неоплазій - реакції антипухлинного імунітету. Прогрес медицини при-
звів до того, що імунна система почала виконувати функції, які не були при-
таманні їй від природи. Мова йде про реакції трансплантаційного імунітету.
Справа в тому, що пересадження органів і тканин у природних умовах - явище
неможливе. Напевно, саме ця особливість пояснює деяку неузгодженість реак-
цій трансплантаційного імунітету.
Нижче детально розглядаються механізми реалізації імунною системою
всіх своїх основних функцій, крім реакцій протипухлинного імунітету, які роз-
глянуті у вигляді окремої глави у IV розділі.
§2. Імунна толерантність
1. Визначення поняття "імунна толерантність"
Імунологічна специфічність рецепторів антигенного розпізнавання Т- і
В-лімфоцитів - результат випадкових комбінацій багатьох генів, які кодують
структуру антигензв'язуючих ділянок таких рецепторів. Теоретично можливе
утворення близько 1015 різноманітних рецепторів, включаючи й ті, що здат-
ні розпізнавати власні антигени. Імунні клітини, які містять антигенрозпізна-
вальні рецептори, специфічні до аутоантигенів, називають аутореактивними.
Цілком зрозуміло, що активація аутореактивних клітин, а значить, пошкоджен-
ня власних клітин, є неприпустимим. Для попередження самопошкодження
реалізуються механізми підтримання імунної толерантності - фундаменталь-
ної властивості імунної системи не відповідати розвитком ефекторних реакцій
при розпізнаванні власних антигенів.
Розрізняють центральну толерантність, механізми якої розгортаються в
центральних імунних органах, та периферійну, яка здійснюється на рівні пе-
риферійних органів. Залежно від типу імунних клітин виділяють В- та Т-клі-
тинну толерантність.
2. Центральна Т-клітинна толерантність
Основний механізм толерантності полягає у видаленні аутореактивних
клітин у тимусі. Незрілі Т-лімфоцити мігрують з червоного кісткового мозку
до тимуса, де дозрівають і зустрічаються з пептидами власних білків організ-
му, що презентуються у складі молекул головного комплексу гістосумісності І
класу на мембрані тимічних епітеліальних клітин. Якщо рецептор антигенно-
го розпізнавання Т-клітини має низьку спорідненість до ендогенних пептидів,
то клітини-носії таких рецеторів зазнають спонтанного апоптозу, оскільки не
отримують достатнього активаційного сигналу. Справа в тому, що для уник-
нення спонтанного апоптозу імунокомпетентні клітини мають взаємодіяти із
структурами власних тканин і постійно отримувати стимуляційні сигнали, які
підтримують життєдіяльність клітини. Т-лімфоцити, які недостатньо ефектив-
но розпізнають власні антигени, не отримують таких активаційних сигналів і
гинуть у зв'язку з запуском спонтанного апоптозу. Виживають тільки Т-лімфо-
цити з проміжною спорідненістю до ендогенних пептидів. В подальшому такі
клітини дозрівають і надходять до периферійної крові (позитивна селекція).
Т-лімфоцити, що мають рецептори з високою спорідненістю до власних анти-
генів, зазнають індукованого апоптозу. В такому випадку в якості антиген-
презентуючих виступають тимічні дендритні клітини. Для цього на поверхні
дендритних клітин з'являються специфічні молекули, що запускають внутріш-
ньоклітинний каскад самоліквідації Т-лімфоцита (див. "Апоптоз як регулятор
імунної відповіді"). Необхідність їх знищення пов'язана з високим ризиком
ініціації такими лімфоцитами аутоімунних реакцій. Механізми знищення до-
зріваючих Т-лімфоцитів шляхом індукованого апоптозу в тимусі називаються
негативною селекцією. Оскільки в тимусі містяться не всі аутоантигени, для
повноцінного підтримання імунної толерантності необхідні периферійні меха-
нізми її підтримання.
3. Периферійна Т-клітинна толерантність
Механізми периферійної толерантності включають безпосереднє знищен-
ня (видалення) аутореактивних Т-лімфоцитів, ігнорування "наївними" Т-клі-
тинами наявних аутоантигенів, а також різні шляхи регулювання активності
імунокомпетентних клітин.
Ігнорування. Як зазначалося раніше, частина аутореактивних Т-лімфо-
цитів надходить до периферичної крові після дозрівання в тимусі. Проте такі
лімфоцити не можуть одразу ж приступити до виконання своїх обов'язків,
оскільки є "наївними" - недостатньо компетентними у зв'язку з тим, що ніколи
не зустрічалися з антигенами. Тому такі Т-лімфоцити не надходять одразу до
тканин, де потенційно може міститися специфічний аутоантиген, а мігрують
до периферійних органів імунної системи, де очікують стимулювальних впли-
вів з боку антигенпрезентуючих клітин. Тут аутореактивні клітини, позбавлені
стимулюючих впливів, залишаються "наївними" протягом всього терміну іс-
нування. Отже, відбувається ігнорування аутоантигенів специфічними кло-
нами аутореактивних Т-лімфоцитів. Активація "наївних" аутореактивних Т-
лімфоцитів можлива, коли антигенпрезентуюча клітина експресує пептид ау-
тоантигену у складі молекули HLA II класу. Це може відбуватися, коли власні
клітини зазнають загибелі і їх фрагменти фагоцитуються. Проте в такому разі
не відбувається експресії на поверхні антигенпрезентуючої клітини так званих
костимуляційних молекул (зокрема, компонентів В7-структури - молекул
CD80 та CD86), оскільки їх поява пов'язана з активацією рецепторів шаблон-
ного розпізнавання, які, як відомо, реагують виключно на екзогенні антигенні
структури - патогензв'язані молекулярні шаблони. Проте в умовах інфекції,
особливо хронічної, можлива тривала активація рецепторів шаблонного роз-
пізнавання молекулярними шаблонами патогену. Певні аутореактивні клітини
можуть активуватися на тлі високої і тривалої експресії костимуляційних мо-
лекул. Тому інфекційне запалення часто супроводжується аутоімунним ком-
понентом, який зникає практично одразу ж після усунення інфекції. Справа в
тому, що за відсутності інфекційного збудника створюються такі рівні ауто-
антигену, що є нижчими за поріг для активації Т-хелперів, оскільки одно-
часно зазнає природної загибелі лише незначна кількість клітин. Окрім того,
має значення зниження експресії костимуляційних молекул після елімінації
патогензв'язаних молекулярних шаблонів.
Цілком зрозуміло, що підтримання підпорогового рівня аутоантигенів у
внутрішньому середовищі можливе здебільшого у разі їх внутрішньоклітин-
ного розташування, адже в такому стані вони приховані від імунного нагляду.
У той же час аутоантигени, що містяться на поверхні клітин, цілком доступні
для імунного розпізнавання. Для уникнення аутоімунних реакцій спрацьовує
наступний механізм - якщо рівень антигену дуже високий, відбувається
згортання імунних реакцій, спрямованих проти цього антигену. Оскільки
власних клітин, що містять аутоантигени, надзвичайно багато, даний механізм
є достатньо дієвим. Слід зазначити, що екзогенні антигени завжди надходять
в організм в обмеженій кількості. Навіть якщо носій антигену є живою сис-
темою, здатною до самовідтворення, кількість патогену буде обмежена за рахунок факторів природженої резистентності. Однак зазначений механізм має
і негативні наслідки (зокрема, у випадку виникнення пухлин). Справа в тому,
що новоутворення, що досягай великих розмірів, зазнають значно меншого
імунного впливу, аніж відносно дрібні пухлини.
Щоб не допустити аутоімунних реакцій, спрямованих проти особливо функ-
ціонально значущих органів, до механізмів підтримання "невігластва" ауторе-
активних Т-лімфоцитів долучається ізоляція аутоантигенів в забар'єрних ор-
ганах (головний і спинний мозок, тканини ока, яєчок). Оскільки непошкоджені
гістогематичні бар'єри цих органів є непроникними для імунокомпетентних клі-
тин, підтримується "невігластво" аутореактивних Т-хелперів і забезпечується
ігнорування ними наявних аутоантигенів. Однак такий, безперечно, ефективний
механізм також може мати негативні наслідки, оскільки він є дієвим лише при
збереженні структури біологічних бар'єрів. У випадку порушення їх проник-
ності цілком можлива активація специфічних клонів аутореактивних Т-клітин.
Оскільки забар'єрні аутоантигени не знайомі імунній системі (їх присутність
не враховується при складанні "плану" забезпечення толерантності), аутоімунні
реакції проти них перебігають набагато тяжче, ніж в інших випадках.
Таким чином, аутореактивні Т-лімфоцити не призведуть до хвороби, якщо за-
лишаться "невігласами" до кінця свого існування або будуть знищеними. Проте
підтримання імунологічної "наївності" не завжди вигідне для організму. Так, деякі
патогени, що мають високий тропізм до периферійних тканин організму (зокрема,
папіломавіруси), також ігноруються імунною системою. Це стосується й мікробів,
при ураженні якими створюється низький рівень антигенних субстанцій.
Видалення (делеція) аутореактивних Т-лімфоцитів. Як зазначалося
вище, презентація ендогенних пептидів без костимуляційних сигналів не тіль-
ки не активує Т-лімфоцити, а й призводить до їхнього апоптозу. Інший механізм
периферичного знищення пов'язаний з нестачею факторів росту, які мають ак-
тивувати Т-клітини. Також загибель Т-лімфоцитів ініціюється взаємодією між
Fas-рецептором (молекулою CD95) та Fas-лігандом (FasL). Встановлено, що
Fas-ліганд викликає апоптоз в Fas-позитивних клітинах. Т-лімфоцити експре-
сують обидва типи молекул, тому вони можуть бути як індукторами апопто-
зу, так і клітинами-мішенями. Зазначений механізм працює наступним чином.
Наприклад, тканини передньої камери ока експресують Fas-ліганд. При над-
ходженні до передньої камери ока аутореактивних Т-лімфоцитів, що є CD95-no-
зитивними, відбувається їх апоптоз без пошкодження тканини.
Регулювання. До механізмів регулювання активності імунокомпетентних
клітин належать анергія, заборона, пригнічення і відхилення.
Анергія - це стан своєрідної бездіяльності Т-лімфоцита після розпізнаван-
ня специфічного антигену. Анергія розвивається, якщо Т-клітина, що зустрілась
з відповідним пептидом, не отримує додаткових костимуляційних сигналів від
антигенпрезентуючих та інших імунокомпетентних клітин, які б свідчили про
екзогенне походження антигену. В такому разі не створюється загальний акти-
ваційний фон, а значить, аутореактивні Т-лімфоцити, перебуваючи у функціо-
нальній самотності, залишаються байдужими до антигенної стимуляції.
Т-лімфоцити, що не продукують інтерлейкін 2 при взаємодії зі специфіч-
ним антигеном, називають анергійними. Інтерлейкін 2 є потужним цитокі-
ном, що синтезується Т-хелперами у разі розпізнавання ними специфічного
антигену (в тому числі аутоантигену) і забезпечує залучення до імунної відпо-
віді багатьох клітин, створюючи активаційний фон, вкрай необхідний для роз-
гортання імунних реакцій. У разі анергії Т-лімфоцит, хоча і здійснює специ-
фічне розпізнавання імуногенного пептиду, проте не зазнає належної активації
і не синтезує інтерлейкін 2, а тому не ініціює розгортання імунної відповіді.
Навпаки, анергійні Т-хелпери синтезують інтерлейкін 10, що пригнічує акти-
вацію Т-клітин. За рахунок анергії аутореактивних Т-лімфоцитів підтримуєть-
ся толерантність до більшості аутоантигенів.
Механізм заборони активації пов'язаний з експресією молекули CD 152
на мембрані Т-хелперів. Встановлено, що CD 152 має вищу спорідненість до
CD80 та CD86, аніж CD28. Як відомо, взаємодія між молекулами CD28 і CD80
(або CD86) створює потужний костимуляційний сигнал, вкрай необхідний для
активації Т-лімфоцита при взаємодії його рецептора антигенного розпізнаван-
ня з комплексом пептид - молекула HLA II класу АПК. Оскільки CD 152 має
більшу спорідненість до компонентів В7-структури, наявність такої молекули
на поверхні Т-лімфоцита попереджує реалізацію костимуляційних впливів, за-
вдяки чому CD 152 "забороняє" активацію Т-хелпера.
Пригнічення (супресія). Трансгенні миші, що мають Т-клітинний рецеп-
тор до власного мієліну, зазвичай здорові, адже аутореактивні лімфоцити не
проходять через гематоенцефалічний бар'єр, не зустрічаються зі специфічним
антигеном, а тому залишаються назавжди "наївними" (некомпетентними).
Проте енцефаліт розвивається після введення ззовні основного білку мієліну
з ад'ювантом (речовиною, що посилює імунну відповідь). Однак через кілька
тижнів виникає спонтанна ремісія. Коли трансгенні миші були спадково змі-
нені, завдяки чому мали збіднений репертуар Т-лімфоцитів, енцефаліт після
імунізації основним білком мієліну не зазнавав спонтанної ремісії, хоча на
перший погляд здається, що нестача спектра Т-лімфоцитів має призвести до
послаблення імунної відповіді. Даний феномен пояснюють наявністю серед
Т-клітин лімфоцитів з фенотипом CD4+CD25+, які мають супресивну актив-
ність завдяки синтезу інтерлейкіну 10 і трансформуючого фактору росту р.
Тому навіть у разі належної стимуляції аутореактивних Т-хелперів з боку ан-
тигенпрезентуючих клітин кінцевий результат (активація або анергія) визна-
чається й функціональним станом супресорних Т-лімфоцитів.
Імунне відхилення як механізм підтримання толерантності ґрунтується
на антагоністичній взаємодії Th 1 і Th 2. Розвиток таких захворювань, як цу-
кровий діабет і хвороба Крона, які опосередковуються аутореактивними Th 1,
можна попередити шляхом стимулювання аутоантигеном Th 2 (рис. 20).
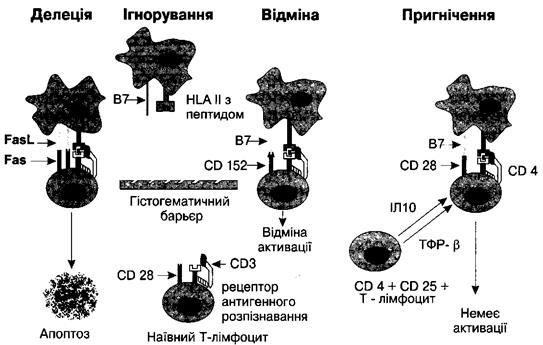
Рис. 20. Основні периферійні механізми підтримання імунної толерантності
Т-клітин.
На рисунку продемонстровано основні механізми підтримання периферійної імунної то-
лерантності: делецію, ігнорування, заборону і пригнічення.
4. В-клітинна імунна толерантність
Антитіла, специфічні до власних ан тигенів організму, називають аутоан-
титілами. Пошкодження, опосередковані аутоантитілами, зустрічаються при
багатьох захворюваннях. Так, при хворобі Грейвса аутоантитіла зв'язуються з
рецепторами до тиротропіну на тироцитах, а при вульгарній пухирчатці синте-
зуються антитіла до епідермальних адгезивних молекул. Раніше вважали, що
антитіла до внутрішньоклітинних антигенів не викликають патологічних про-
цесів і утворюються тільки у разі пошкодження тканини, коли вивільняються
внутрішні антигени. На моделі аутоімунного артриту у тварин це твердження
було спростовано. Перенесення аутоантитіл IgG до внутрішньоклітинного ан
тигену глюкозо-6-фосфатізомерази від хворої тварини до здорової викликало
розвиток артриту у здорової.
До центральних механізмів В-клітинної толерантності належить знищення
аутореактивних ранніх В-лімфоцитів у червоному кістковому мозку шляхом
апоптозу. Проте аутореактивні В-лімфоцити, на відміну від Т-клітин, мають
шанс уникнути апоптозу, якщо встигнуть здійснити редакцію небажаного ре-
цептора. "Редакція рецепторів" - це зміна специфічності імуноглобуліно-
вого рецептора В-лімфоцита після розпізнавання аутоантигену. Це явище
може відбуватися тільки у тих незрілих В-клітин, які ще зберегли різноманіт-
ність сегментів V-гена. При цьому після розпізнавання специфічного аутоан-
тигена вмикаються рекомбінази, що долучають новий V-сегмент до комплексу
DJ замість скомпрометованого.
Оскільки аутоантигенів, що подаються в кістковому мозку дозріваючим
В-лімфоцитам для специфічного розпізнавання, обмаль, створюється можли-
вість для виживання аутореактивних клонів. У такому разі мають спрацювати
периферичні механізми індукції В-клітинної толерантності. До них належать
знищення аутореактивних В-лімфоцитів у Т-залежних зонах лімфатичних вуз-
лів та селезінки, а також функціональна інактивація їх - анергія.
Очевидно, всі ці механізми розвиваються тому, що активовані аутоанти-
геном В-лімфоцити не отримують другого стимуляційного сигналу від Т-хел-
перів. Слід зазначити, що підтримання толерантності на рівні В-ланки здій-
снюється менш ефективно, аніж серед Т-лімфоцитів, тому в організмі існує
багато аутореактивних В-лімфоцитів, що активно розпізнають аутоантигени.
Скоріше за все, це обумовлено тим, що В-лімфоцити, на відміну від Т-клітин,
можуть самостійно розпізнавати натуральний антиген за рахунок імуноглобу-
лінових рецепторів. У зв'язку з цим важко підтримувати їх невігластво. Проте
реалізації імунної відповіді не відбувається, оскільки для ефективної активації
В-лімфоцитів необхідний стимуляційний вплив з боку Т-хелперів, що полягає
у виробленні цитокінів і у безпосередньому контакті між цими клітинами. Так,
у мишей, генетично модифікованих на синтез на поверхні їх тироцитів чужо-
рідних білків (курячого лізоциму), формуються численні В-клітини зі специ-
фічними рецепторами до лізоциму. Проте у них не виявляється жодних ознак
тироїдиту, що є наслідком підтримання Т-клітинної толерантності.
5. Особливі види імунної толерантності
Пероральна толерантність. При проникненні АГ через слизову ШКТ від-
бувається переважне формування Th 2, які підтримують синтез специфічних
slgA. Паралельно Th 2 секретують цитокіни ІЛ-10 й ТФР-р, які не тільки при
гнічують Th 1 реакції, але й чинять загальний антизапальний ефект. Зокрема,
ТФР-Р інгібує проліферацію В-лімфоцитів, ПК, цитотоксичних Т-клітин і про-
тидіє ефектам ФНП-а.
Толерантність до антигенів плоду. Плід містить антигени батька, однак
материнський організм не реагує на них розвитком імунних реакцій. Причина
цього - гормональні перебудови під час вагітності, які призводять до переваж-
ного утворення Th 2. Імунна ж відповідь проти плоду є клітинною, тобто опо-
середковується Th 1. До моменту пологів захисне гормональне тло знімається
і Th 1 реакції можуть бути реалізованими. У зв'язку з цим з імунологічних
позицій пологи є своєрідною реакцією відторгнення трансплантату.
6. Механізми зриву імунної толерантності
Коли механізми імунної толерантності виявляються неефективними, роз-
виваються імунні реакції самопошкодження, названі аутоімунними. В біль-
шості випадків ці реакції мають транзиторний характер, оскільки повноцінна
імунна відповідь може реалізуватись тільки при належній активації всіх рівнів
імунної відповіді, а не тільки при зрушенні в окремій ланці. Як уже вказу-
валося, умови для активації певних аутореактивних клітин можуть виникати
в окремі моменти онтогенезу, проте здебільшого активовані лімфоцити зали-
шаються у функціональній самотності і не можуть розвинути достатню для
клінічної маніфестації аутоімунну відповідь. Причинами зриву толерантності
можуть бути:
1) порушення видалення аутореактивних Т-лімфоцитів у тимусі;
2) активація потенційно аутореактивних Т-лімфоцитів інфекційними агентами.
Механізми, посередництвом яких інфекція провокує розвиток аутоімун-
них реакцій, включають:
а) вивільнення аутоантигенів при пошкодженні тканини інфекційним збудником;
б) активація кількох клонів Т-лімфоцитів суперантигенами мікроорганізмів;
в) індукція синтезу прозапальних цитокінів, що створюють активаційний фон
для лімфоцитів;
г) посилення експресії костимуляційних молекул завдяки активації fo/Z-рецеп-
торів мікробними шаблонами.
д) молекулярна мімікрія - структурна подібність між мікробними антигенами
та власними.
Проте останнім часом механізм мімікрії підлягає переосмисленню, оскіль-
ки встановлено, що в нормі один рецептор Т-лімфоцитів може розпізнавати
кілька пептидів навіть без суворої гомології між ними.
Слід зазначити, що інфекція може виступати і у ролі фактора, що попереджує
розвиток аутоімунних реакцій. Це відбувається шляхом активації клітин-супресорів. Доказом є наступний факт - часті інфекції протягом першого року життя
асоціюються з вірогідним зниженням ризику розвитку аутоімунного діабету.
7. Терапевтичні можливості
Мета терапії полягає у попередженні реактивації аутореактивних Т-клі-
тин, що забезпечує відновлення імунної толерантності. Це є надзвичайно
складною проблемою, оскільки зрив толерантності часто є наслідком багато-
рівневих порушень, а тому терапевтичний вплив лише на одну ланку в біль-
шості випадків не призводить до очікуваних результатів. Одним з напрямків
лікування є парентеральне введення причинного антигену, що справляє
імуномодулюючий вплив. Встановлено, що у ЗО % хворих на гемофілію, що
отримують інфузії VIII фактора системи зсідання крові, в плазмі з'являються
антитіла до препарату. Для того, щоб усунути ефект антитіл, тобто індукува-
ти імунну толерантність, необхідні тривалі щоденні інфузії великих доз VIII
фактора. Ця терапія здатна викликати толерантність на 1 рік у 80 % пацієнтів.
Крім того, встановлено, що постійні ін'єкції ослабленого антигену індукують
толерантність Т-хелперів і можуть попередити експериментальний енцефаліт.
Були проведені клінічні випробування парентерального введення пептидів,
отриманих з причинних аутоантигенів при цукровому діабеті, алергії, розсія-
ному склерозі. Профілактична терапія при ризику розвитку аутоімунного за-
хворювання була ефективною, але успіхи в лікуванні пацієнтів зі встановле-
ним діагнозом досить обмежені.
Згідно до іншого підходу, можна індукувати толерантність шляхом перо-
рального введення причинного антигену. Так, пероральний прийом кола-
гену попереджував колагеніндукований артрит у мишей, а оральний прийом
основного білка мієліну або інсуліну попереджував розвиток у тварин енцефа-
літу та цукрового діабету відповідно. Знову ж таки результати лікування вже
сформованої патології не такі обнадійливі.
Існують пептиди, що інгібують активацію окремих клонів Т-лімфоцитів.
Вони називаються пептидами-антагоністами. Призначення в якості терапії ан-
тагоністів причинних пептидів попереджувало розвиток аутоімунного енцефалі-
ту у мишей. Недоліком цього методу є те, що імунна відповідь у людей є полікло-
нальною, а введений пептид, інгібуючи один клон, може стимулювати інший.
Терапія розчинним CD152 попереджує взаємодію костимуляційних моле-
кул CD80 і CD86 антигенпрезентуючих клітин з рецептором CD28 Т-хелперів.
Терапія препаратом CD 152 полегшує перебіг системного червоного вовчаку,
аутоімунного енцефаліту та артриту у мишей. Перша фаза клінічних дослі-
джень показала ефективність цього препарату при лікуванні псоріазу. Проте
при такому лікуванні можна отримати неочікувані наслідки, оскільки сигнал,
що передається за рахунок CD28, необхідний також для активації CD4+CD25+
Т-клітин, які, як відомо, обмежують аутоімунні реакції. Тому виявилося, що
блок CD28 костимуляційної молекули у мишей з аутоімунним діабетом скорі-
ше погіршує, а не полегшує перебіг хвороби.
Т-лімфоцити можна розділити за цитокінами, які вони продукують. Т-хел-
пери 1 типу синтезують переважно інтерферон-у, фактор некрозу пухлини а і
інтерлейкін 2, а Т-хелпери 2 типу - ІЛ 4, ІЛ-5, ІЛ-6 й ІЛ-13. Так, розсіяний скле-
роз і діабет І типу ініціюють хелпери 1 типу, а алергійні захворювання - Т-хел-
пери 2 типу. Отже, зміна балансу цитокінів за рахунок цитокінвмісних препа-
ратів або індукторів цитокінів може бути цілком привабливою терапевтичною
перспективою. Проте складність проблеми полягає у тому, що немає "чистих"
клітин 1 і 2 типу - Т-хелпери 2 типу наділені частковими ефектами Т-хелперів
1 типу і можуть призводити до демієлінізації або руйнування панкреатичних
Дата добавления: 2016-08-07; просмотров: 536;
