в історичному аспекті 6 страница
реакцій необхідне залучення клітинного компоненту, і навпаки, ефективність
клітинного імунітету зростає при паралельному синтезі специфічних антитіл.
Отже, гуморальна і клітинна ланка є не антагоністичними, а взаємодоповнюю-
чими компонентами імунної системи. Порівняльна характеристика Т- і В-лім-
фоцитів наведена у таблиці 5.
Таблиця 5.

2. Стратегія і тактика розпізнавання антигенів факторами
набутого імунітету (рецептори антигенного розпізнавання)
У попередніх параграфах ми з'ясували, яким чином відбувається розпізна-
вання чужорідних агентів компонентами природжених механізмів резистент-
ності. Мова йшла про рецептори шаблонного розпізнавання, що специфіч-
ні до найбільш типових мікробних структур, а також рецептори до опсоні-
нів - молекул, які "прилаштовують" відносно бідний репертуар рецепторів
природженого імунітету до антигенної різноманітності збудників. У зв'язку
з суттєвим обмеженням рецепторних ресурсів природжені механізми резис-
тентності реагують однотипово на різні патогени, навіть якщо останні суттєво
відрізняються між собою. Так, наприклад, захисні механізми проти Е. соїі та
S. typhi, не дивлячись на суттєві відмінності між цими мікроорганізмами, бу-
дуть подібними. Найбільш адекватний захист можна забезпечити тільки після
розпізнавання усіх антигенних детермінант, які містить збудник, що дозволяє
визначити оптимальну силу і спрямованість імунної відповіді щодо даного па-
тогену. Таке високоспецифічне розпізнавання здійснюють рецептори імуно-
компетентних клітин. Оскільки в цілому епітопів мікробів надзвичайно ба-
гато, генів, що містяться в геномі людини і кодують структуру антигензв'язу-
ючих сайтів, катастрофічно не вистачає. Вихід з цієї ситуації один - продуку-
вати нові нуклеотидні послідовності на основі порівняно невеликої кількості
генів антигенного розпізнавання за рахунок численних випадкових перебудов
- рекомбінацій генетичного матеріалу. Власне процеси рекомбінації вклю-
чають вирізання, перенесення, стикування і модифікацію полінуклеотидних
послідовностей, що створює надзвичайно велику різноманітність антигенроз-
пізнавальних рецепторів.
Рецептори антигенного розпізнавання лімфоцитів складаються з двох
принципових частин - варіабельної, яка є специфічною до певного антигену і
є унікальною у кожної клітини, та константної (незмінної). Цілком зрозуміло,
що рекомбінацій зазнають гени, що кодують саме варіабельні ділянки. Останні
і формують так звані антигензв'язуючі сайти, які безпосередньо взаємодіють
з епітопами патогена.
Розглянемо процеси рекомбінації на прикладі формування В-клітинно-
го антигенрозпізнавального рецептора, який може перебувати у вигляді двох
форм - мембранної та секреторної. В останньому випадку синтезований ре-
цептор позбавлений ділянки, за рахунок якої він має змогу приєднатися до ци-
толеми клітини-продуцента. Тому цей рецептор вимушено залишає материн-
ську клітину і надходить до внутрішнього середовища організму. Секреторні
антигенрозпізнавальні рецептори В-лімфоцитів більш відомі під назвою анти-
тіл (імуноглобулінів). Константні (незмінні) ділянки антитіл можуть розпіз-
наватися різноманітними факторами природженої резистентності. Оскільки
антитіла містять варіабельні фрагменти, високоспецифічні до конкретних ан-
тигенів збудників, чинники природженої резистентності значно розширюють
власні розпізнавальні можливості, які, як відомо, зазвичай є дуже обмежени-
ми. Це і є головним призначенням антитіл.
Ген, що кодує структуру варіабельної ділянки, отримав назву V-гена (від
англ. variable - різноманітний). Він складається з трьох сегментів - V-сегменту
(власне варіабельного), D-сегменту (додаткової різноманітності) та J-сегменту
(сполучного, від англ. - joining). Особливістю V-гена є те, що стартово він не
існує в геномі як цілісна структура. У різних ділянках ДНК містяться лише
його складові сегменти (V, D і J), представлені багатьма варіантами. Так, вста-
новлено, що V-група містить до 1000 сегментів, D-rpyna - 10, a J - 4. Проте
для побудови антигензв'язуючого сайту рецептора достатньо комбінації лише
трьох сегментів - по одному з кожної із зазначених груп. Значний набір різних
варіантів одного й того ж самого сегмента забезпечує надзвичайно широкі мож-
ливості для генетичних рекомбінацій, в результаті яких і створюється V-ген.
Рецептор антигенного розпізнавання В-лімфоцита складається з двох лан-
цюгів - важкого та легкого, які відрізняються за довжиною (а значить - і
молекулярною масою), звідки і отримали свою назву. У побудові антигензв'я-
зуючої ділянки беруть участь обидва ланцюги, а кінцеву (хвостову) частину
константної формує лише один важкий ланцюг. Тому для синтезу рецептора
необхідно створити принаймні два V-гени - для синтезу варіабельної ділян-
ки важкого і легкого ланцюга. Як уже зазначалося, стартово V-ген не існує
як цілісна структура, а представлений розрізненими фрагментами - V-, D- та
J-сегментами, де міститься інформація про будову варіабельних ділянок. За
синтез константної ділянки відповідає так званий С-ген, який також представ-
лений кількома сегментами, що містяться в ДНК разом і визначають класову
належність антитіл. Відомо 5 основних класів імуноглобулінів - IgM, IgG (G,,
G2, G3, G4 підкласи), IgA (A,, A2 підкласи), IgE та IgD. їх С-сегменти позна-
чаються грецькими відповідниками. Ці сегменти розташовуються в геномі в
наступному порядку: Сд, С8, Су3, Су,, Са, Су2, Су4, Сє, Са2. Як буде показано
нижче, така послідовність і визначає порядок синтезу одним В-лімфоцитом
імуноглобулінів різних класів.
Принцип формування V-гена полягає у випадковому виборі по одному сег-
менту з трьох груп (V, D, J) і їх просторовому зближенні. При цьому всі ділянки
ДНК, що розташовані між обраними сегментами, вирізаються. Спочатку оби-
раються D- та J-сегменти, а потім до утвореного комплексу DJ приєднується
один із сегментів V-групи. Утворена послідовність V-D-J і є V-геном. Виникає
питання: на якій підставі відбувається вибір сегментів із зазначених груп для
формування V-гена? Відповідь - випадково. Випадковість забезпечується ак-
тивацією спеціальних ферментів - рекомбіназ, здатних навмання обирати по
одному сегменту з кожної групи і долучати їх один до одного. Встановлено,
що подібні ферменти синтезуються принаймні на двох генах (RAG1 і RAG2),
які названі рекомбінант-активуючими. За виконуваною роботою ферменти,
задіяні у створенні V-гена, можна поділити на нуклеази (екзо- та ендо-), які
розрізають ланцюги або зсередини (ендонуклеази), або з кінця (екзонуклеази),
трансферази, які здійснюють перенесення сегментів або окремих нуклеотидів,
і лігази, що зшивають компоненти новоутворених комбінацій, відновлюючи
неперервність ниток ДНК. Як працюють рекомбінази? Спочатку відбувається
просторове зближення випадково обраних сегментів, у зв'язку з чим ділянка
ДНК, розташована між ними, збирається в складку, названу "петлею". Після
цього утворена петля набуває стабільної конфігурації, утримуючи обрані сег-
менти один біля одного. Справа в тому, що ділянки ДНК між групами сегмен-
тів V-гена містять симетрично розташовані комплементарні одна одній зони.
У зв'язку з симетричністю розташування при утворенні петлі такі зони опиня-
ються навпроти одна одної, а завдяки комплементарності нуклеотидного скла-
ду - з'єднуються між собою за принципом замка-блискавки. Як тільки петля
набула стабільної кофігурації, нуклеази відрізають її з обох боків, а лігази по-
єднують обрані сегменти V-гена, відновлюючи неперервність ланцюга ДНК.
Оскільки кількість V-сегментів найбільша, то випадковий вибір саме сег-
мента цієї групи головним чином визначає різноманітність рецепторного ре-
пертуару. Окрім того, V-сегменти найдовші і кодують близько 95 амінокислот-
них залишків, в той час як комплекс DJ - не більше 14. Тому більша частина
варіабельної ділянки побудована саме із продукту V-сегменту. D-сегменти (від
англ. - diversity) є факторами додаткової різноманітності. Реальна кількість та-
ких сегментів набагато більша за фактичну. Справа в тому, що ділянка ДНК,
де містяться D-сегменти, може зазнавати транскрипції в трьох рамках зчиту-
вання, одна з яких обирається випадково. При цьому в умовах кожної рамки
зчитування повністю змінюється зміст усіх сегментів D-групи, тобто "виника-
ють" нові сегменти. Це обумовлено триплетністю генетичного коду. При зміщенні початку транскрипції лише на один нуклеотид відбувається умовний
перерозподіл нитки ДНК на трійки нуклеотидів, що змінює склад усіх трипле-
тів, а значить, обумовлює подальший синтез поліпептидного ланцюга нового
амінокислотного складу. J-група мало впливає на формування різноманітності
рецепторного апарату, оскільки містить обмаль сегментів. Проте саме вони
сполучають варіабельну ділянку антитіла з константною (звідси і назва).
Не дивлячись на те, що антитіла відрізняються між собою саме за струк-
турою варіабельного фрагмента, більша частина цієї ділянки ідентична у всіх
імуноглобулінів. Мова йде про каркасну зону. Справа в тому, що всі сегменти
V-гена, що входять до складу однієї групи (V, D або J), містять однакові по-
слідовності нуклеотидів, які й визначають їх групову належність. При тран-
сляції стабільних групових послідовностей V-гена і формується каркасна зона
варіабельної ділянки імуноглобуліну. Разом з тим, кожен сегмент групи міс-
тить специфічні послідовності нуклеотидів, які визначають його унікальність.
Такі послідовності і забезпечують формування мінливих ділянок. Оскільки
весь фрагмент називається варіабельним, ці ділянки отримали назву гіперва-
ріабельних. Всього їх 3 - стільки ж, скільки і складових V-гена. Тому каркас
поділяється гіперваріабельними ділянками на 4 фрагменти. Каркасна зона і
гіперваріабельні утворення мають різне білогічне значення. Так, саме каркас-
на частина забезпечує формування гідрофільного каналу, який міститься між
варіабельними ділянками важкого і легкого ланцюга антитіла. Утворений ка-
нал працює щодо антигенних детермінант патогену подібно до "капкана" і од-
наковий у всіх імуноглобулінів, тобто всі антитіла мають спільний принцип
взаємодії з патогеном. У цьому і полягає біологічне значення каркасних зон.
Специфічність зв'язування, тобто який саме епітоп патогену буде розпізнава-
ти дане антитіло, визначається гіперваріабельними ділянками. Оскільки саме
вони сформовані випадковим чином, кожна В-клітина буде забезпечена анти-
генрозпізнавальним рецептором унікальної специфічності.
За рахунок випадкової комбінації сегментів утворюється величезна кіль-
кість різноманітних V-генів. Якщо врахувати, що у формуванні цілісного ре-
цептора бере участь і легкий ланцюг, утворений за подібними принципами, то
кількість різноманітних антигензв'язуючих сайтів збільшується до 10". Проте
навіть така кількість різноманітних комбінацій є недостатньою для ефективно-
го розпізнавання епітопів всіх можливих патогенів. Для розширення різнома-
нітності залучаються додаткові випадкові механізми, які змінюють структуру
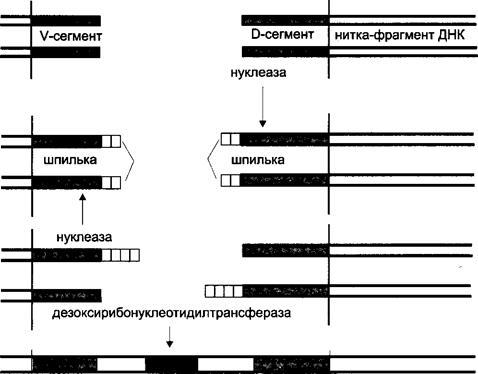
місця з'єднання V і D-сегментів (рис. 11).
Внаслідок видалення ділянки ДНК, що міститься між випадково обраними
V- і D-сегментами, нуклеїнова кислота розривається на дві нитки-фрагменти.
На кінцях фрагментів, які обернені один до одного, і містяться відповідно V- і

D-сегмент. Ці вивільнені кінці дуже уразливі, оскільки вони є оголеними час-
тинами молекули, а тому потенційно чутливі до деструктивних впливів, що
ставить під загрозу існування всієї ДНК. Для стабілізації молекули ферменти
репарації навмання добудовують короткі нуклеотидні послідовності до оголе-
них кінців - по дві з внутрішніх кінців ниток-фрагментів, оскільки ДНК, як
відомо, є дволанцюговою молекулою. Потім добудовані послідовності зами-
каються "самі на себе" за рахунок формування 3 -б'-складноефірного зв'язку
між терміналями ланцюгів ДНК. При цьому оголені кінці зникають. Утворена
кінцева структура отримала образну назву "шпильки". Проте шпильки пере-
шкоджають відновленню неперервності ДНК, тобто з'єднанню ниток-фраг-
ментів між собою. Тому ендонуклеази розривають нуклеотидну послідовність
в основі однієї із ніжок шпильки. За рахунок цього знову вивільняється ого-
лений кінець одного з полінуклеотидних ланцюгів нитки-фрагмента, а кінець
другого прикривається полінуклеотидною добудовою подвійної довжини. На
терміналі другої нитки відбуваються подібні зміни. Потім має місце реплікація
добудов на обох нитках-фрагментах і з'єднання останніх. Тому при сполученні
V- і D-сегментів між ними опиняються дві ділянки випадкових послідовностей
(так звані Р-фрагменти), які дещо змінюють структуру майбутнього V-гена.
Більше того, під час поєднання ниток-фрагментів спеціальний фермент дезок-
сирибонуклеотидилтрансфераза встигає навмання вбудувати в місце з'єднання
ще кілька нуклеотидів, що призводить до подальших змін у V-гені. Саме таким
чином між Р-фрагментами формується N-фрагмент випадкового складу - ре-
зультат діяльності зазначеної трансферази. Тому при формуванні варіабельних
ділянок рецепторів поряд з комбінаційними мають місце і певні мутаційні змі-
ни (випадкові послідовності і вбудовані нуклеотиди), за рахунок яких ново-
|
| V Р N Р D |
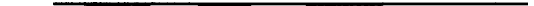 |
утворений V-ген не є простою сумою V-, D- та J-сегментів (рис. 12).
Після того як V-ген сформовано, процеси рекомбінації ДНК призупиня-
ються і починається транскрипція новоутвореної послідовності нуклеотидів,
яка включає власне V-ген, сегменти V- та J-груп, що не були вирізані при зро-
щуванні ланцюгів, а також всі С-сегменти. При цьому утворюється так звана
первинна РНК. В подальшому первинна РНК зазнає сплайсингу ("дозріван-
ня") - всі її С-сегменти та незадіяні V- і J-сегменти вирізаються, залишається
лише V-ген та Сц, При цьому первинна РНК перетворюється в РНК-попе-
редницю. В процесі трансляції на такій РНК-попередниці буде сформовано
важкий ланцюг майбутнього рецептора, який з'явиться на поверхні лімфо-
цита разом з сурогатним ланцюгом. Останній кодується генами, які не зазна-
ють перебудови. Експресія хоча б такого антигенрозпізнавального рецептора
необхідна імунокомпетентній клітині для взаємодії з мікрооточенням і подаль-
шого виживання. Справа в тому, що взаємодія з епітеліоїдними клітинами, які
складають мікрооточення, перешкоджає спонтанному апоптозові лімфоци-
та. Це означає, що виживають тільки ті імунокомпетентні клітини, що здатні
розпізнавати структури власного організму. На цьому етапі вибраковуються
лімфоцити, які містять дефектні антигензв'язуючі ділянки важких ланцюгів.
Оскільки процеси рекомбінації відбуваються навмання, клітин з такими ре-
цепторами буде досить багато. У подальшому в процес рекомбінації будуть
залучені гени легких ланцюгів антитіла, які і змінять сурогатні ланцюги на
поверхні клітини. Слід зазначити, що V-ген легкого ланцюга формують лише
V- та J-сегменти. Так утворюється первинний антигенрозпізнавальний рецеп-
тор В-лімфоцита - IgM-мономер (рис. 11).
Якщо В-лімфоцит набуває зрілості, він також експресує IgD-рецептор.
Синтез інших рецепторів відбувається лише під час реалізації імунної відпо-
віді, оскільки для цього необхідний відповідний цитокіновий вплив та контакт
з активованим Т-лімфоцитом. Перемикання на синтез антитіл іншого класу
відбувається за рахунок використання інших С-сегментів, що призводить до
зміни нуклеотидних послідовностей не в інформаційній РНК, як це було при
дозріванні клітини, а на рівні ДНК. При цьому знову активуються нуклеази,
які виділяють і долучають один із С-сегментів (відповідно до цитокінового
профілю) до комплексу VDJ. Всі інші С-сегменти, розташовані в ланцюгу пра-
воруч від обраного, вирізаються і назавжди втрачаються В-лімфоцитом. Тому
В-клітина не може синтезувати, наприклад, імуноглобулін М після імуногло-
буліну G, оскільки при синтезі останнього був втрачений сегмент Сц, який
кодує константну ділянку IgM і знаходиться ліворуч від будь-якого з Су-сег-
ментів. Але цілком природним буде перехід, зокрема, з синтезу IgM на синтез
IgG,. Таким чином, В-лімфоцит, що синтезує IgA2, вже не може синтезувати
жодного іншого антитіла, оскільки безповоротно втратив всі С-сегменти, окрім
Са2. Тепер ми можемо пояснити, чому під час дозрівання В-клітини долучення
С-сегмента відбувається на рівні РНК і утворюється саме IgM. Збереження
всіх С-сегментів ДНК дозволить В-лімфоциту синтезувати в подальшому будь-
який клас антитіл. При цьому всі антитіла даної В-клітини, незалежно від їх
класу, будуть містити однакові антигензв'язуючі сайти, оскільки вся різнома-
нітність V, D і J-сегментів втрачена ще в період дозрівання. Змінюється лише
експресія С-сегментів (рис. 13).
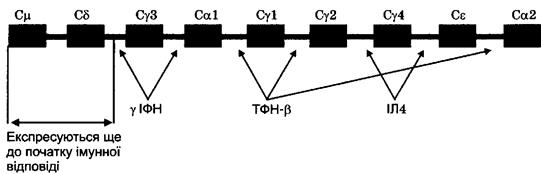
Рис. 13. Цитокінова регуляція синтезу антитіл різних класів
Подібним чином формуються рецептори Т-клітин. Вони мають спільний з
антитілами принцип будови і також формуються на підставі V-, D- та J-сегмен-
тів відповідних V-генів. Слід зазначити, що Т-лімфоцити утворюють власні
рецептори не з важкого і легкого, а з а і Р-ланцюгів. Такі рецептори можуть
розпізнавати не натуральний антиген, а лише його частину - імуногенний пеп-
тид, який повинен перебувати у комплексі з молекулою HLAII типу на поверх-
ні антигенпрезентуючої клітини. У випадку відсутності експресії молекули
головного комплексу гістосумісності, а/р Т-лімфоцити не зважають на анти-
генну стимуляцію. Слід наголосити, що антитіла також не розпізнають всього
антигену, оскільки вони обмежуються взаємодією лише з його фрагментами
- антигенними детермінантами (епітопами). Тому принципова відмінність
розпізнавання Т- і В-лімфоцитів полягає у носії фрагмента антигену. Для Т-
клітин роль носія виконує молекула гістосумісності, а для антитіл - сам пато-
ген. Проте існують Т-клітини, що формують власні рецептори з у і 8-ланцюгів.
Такі лімфоцити працюють на слизових і перешкоджають формуванню вхідних
воріт інфекції. їх y/5-рецептори, подібно до антитіл, здатні розпізнавати на-
туральний антиген, тобто антигенну субстанцію, яка не зазнала процесингу
в антигенпрезентуючій клітині. Наприклад, у/8 Т-лімфоцити розпізнають так
звані стрес-білки (білки теплового шоку). Останні синтезуються власними
клітинами при ураженні внутрішньоклітинними паразитами, а також самими
патогенами (наприклад, мікобактеріями і кандидами) у випадку агресії з боку
факторів природженої резистентності. При розпізнаванні подібних структур
y/5-T-лімфоцит починає виконувати кілерну функцію, яка полягає у знищенні
інфікованої клітини або самого інфекційного агента. Лише в рідкісних випад-
ках HLA-подібні молекули (наприклад, CD1) можуть презентувати деякі анти-
гени (найчастіше ліпіди і гліколіпіди) для y/8-Т-лімфоцитів.
Резюме. Процес формування рецепторів антигенного розпізнавання іму-
нокомпетентних клітин є проявом комбінаційної мінливості. При цьому не
утворюються нуклеотидні послідовності de novo, а відбувається перегрупу-
вання уже наявних фрагментів ДНК. Це явище отримало назву рекомбінації
генетичного матеріалу, або реаранжирування генів. Щоправда, до комбінацій-
них механізмів долучаються процеси, подібні до мутаційних змін. Мова йде
про випадкові термінальні послідовності, які утворюють два Р-фрагменти, та
вбудовані нуклеотиди, що формують N-ділянку. Тому новоутворений V-ген не
є простою сумою складових сегментів.
До власне механізмів комбінаторики належать:
1) випадковий вибір однієї гомологічної хромосоми з пари для рекомбінації
сегментів V-гена;
2) випадковий вибір одного сегмента з кожної групи (V, D, J);
3) випадковий вибір рамки зчитування ділянки D-сегментів; встановлено мож-
ливість принаймні трьох рамок зчитування такої ділянки, причому в кож-
ному випадку повністю міняється зміст усіх сегментів групи (особливість
триплетного коду);
4) випадкове поєднання субодиниць антигенроз-пізнавального рецептора
(важкого і легкого ланцюгів В-лімфоцитів або а- і Р-ланцюгів Т-клітин),
для кожного з яких справджуються перші три механізми комбінаторики.
Слід зазначити, що в організмі існує багато В-лімфоцитів з ідентичними
важкими ланцюгами і Т-клітин з однаковими р-ланцюгами. Вони є резуль-
татом проліферації незрілих лімфоцитів із вдалими "пробними" рецептора-
ми антигенного розпізнавання. Проте в імунній системі кожен лімфоцит за-
безпечений унікальним антигенрозпізнавальним рецептором, оскільки для
його утворення потрібен ще інший компонент (відповідно легкий ланцюг і
а-ланцюг), які також сформовані випадковим чином. Поєднанні двох частин
рецептора і створює комплекс унікальної специфічності.
За рахунок таких процесів організм здатен продукувати безліч рецепторів
антигенного розпізнавання, а значить, має можливість розпізнати практично
будь-який антиген, що існує в природі. Оскільки антигензв'язуючі сайти зге-
неровано навмання, вони не призначені для розпізнавання якогось конкретно-
го збудника. Більше того, більшість із сформованих рецепторів ніколи не вико-
ристовується організмом, оскільки протягом існування до нього не надходять
відповідні за структурою антигени. Проте надзвичайна різноманітність антигенрозпізнавальних рецепторів забезпечує готовність макрооганізму практич-
но до будь-якої агресії, що, звичайно, підвищує його шанси на виживання,
оскільки надходження патогенів - також до певної міри явище випадкове.
3. Цитокінова система організму
Перш ніж перейти до розгляду механізму імунної відповіді, слід зупинитись
на так званих цитокінах, які наділені функцією медіаторів імунної системи.
Цитокінами називають велику групу біологічно активних пептидів, яким
властива гормоноподібна дія, що полягає у забезпеченні взаємодії клітин імун-
ної, кровотворної, ендокринної та нервової систем. Сукупність цитокінів, що
вивільняються під час реалізації імунної відповіді, складає так званий "цито-
кіновий каскад". Умовно виділяють цитокіни першого покоління (так звані
доімунні цитокіни), які продукуються клітинами природженої резистентності,
і цитокіни другого покоління - продукти секреторної активності імунокомпе-
тентних клітин. Антигенна стимуляція призводить до секреції цитокінів пер-
шого покоління (ФНП-а, ІЛ-ір і ІЛ-6), які індукують біосинтез ІЛ-2, що ви-
ступає у ролі центрального регуляторного цитокіну, а також ІЛ-3, ІЛ-4, ІЛ-5
та інтерферону-у (цитокінів другого покоління). У свою чергу, вивільнені ци-
токіни другого покоління здійснюють коригуючий вплив на біосинтез ранніх
цитокінів. Такий принцип дії дозволяє залучати до імунної відповіді постійно
зростаючу кількість клітин.
Основними продуцентами цитокінів є Т-хелпери і макрофаги. Цитокіни
виявляють свою дію шляхом дії на рецептори мембран клітин-мішеней. У
процесі росту і диференціювання клітин крові, а також при розвитку імунної
відповіді відбувається модуляція (індукція, посилення, послаблення) експресії
цитокінових рецепторів, у зв'язку з чим на різних стадіях змінюється чутли-
вість клітин-мішеней до дії певних цитокінів. Модуляторами експресії таких
рецепторів часто слугують самі цитокіни, причому в деяких випадках цитокін
здатний змінювати експресію власного рецептора.
Основні властивості цитокінів:
1) синтезуються в процесі імунної відповіді;
2) мають численні джерела продукції;
3) чинять регуляторний вплив на процес імунної відповіді;
4) проявляють активність за дуже низьких концентрацій;
5) діють як фактори росту та диференціювання клітин;
6) один цитокін може виконувати декілька принципово різних функцій (пле-
йотропний ефект);
7) принципово різні цитокіни можуть виявляти подібну дію (дублюючий ефект).
Всі цитокіни поділяють на такі групи:
• Інтерлейкіни - секторні регуляторні пептиди імунної системи, які забезпе-
чують взаємодію клітин в імунній системі та її зв'язок з іншими системами
організму;
• Інтерферони - противірусні цитокіни з вираженими імунорегуляторними
властивостями;
• Фактори некрозу пухлин - цитокіни із цитотоксичними і регуляторними
властивостями (ФНО-а і ФНО-(3 [лімфотоксин]);
• Колонієстимулюючі фактори (КСФ) - стимулятори росту і диференцію-
вання гемопоетичних клітин;
• Хемокіни - хемоатрактанти для лейкоцитів;
• Фактори росту - регулятори росту, диференціювання і функціональної ак-
тивності клітин різних тканин (фактор росту фібробластів, фактор росту
ендотеліоцитів, фактор росту епідермісу і трансформуючий фактор росту).

Функції основних інтерлейкінів наведені в таблиці 6.


За функціональною активністю цитокіни поділяють на про- і протизапаль-
ні. До прозапальних цитокінів належать ІЛ-1 Р, ІЛ-2, ІЛ-6, ІЛ-8, ГМ-КСФ, ін-
терферони і ФНП-а. Антизапальними цитокінами є ІЛ-4, ІЛ-10, ІЛ-13 і ТФР-р.
Нижче подано коротке описання основних цитокінів.
Фактор некрозу пухлини альфа (ФНП-а) вважається одним із централь-
них регуляторів факторів природженої резистентності (поряд із ІЛ-ір, ІФН
а і Р). Виявляє багато біологічних ефектів, значна частина з яких аналогіч-
на таким у ІЛ-1 р. Тривале перебування ФНП-а в кровообігу призводить до
виснаження м'язової і жирової тканини (кахексії) і супресії кровотворення.
Більшість біологічних ефектів ФНП-а потенціюються ІФН-у. Основними клі-
тинами-продуцентами цього цитокіну є стимульовані бактеріальними шабло-
нами макрофаги і активовані природні кілери. Слід зазначити, що ФНП-а є
основним медіатором, який синтезується організмом у відповідь на вторгнен-
ня патогенних грамнегативних бактерій, причому молекулярним шаблоном,
що активує синтез даного цитокіну, є ліпополісахариди мікробної стінки.
Фактор некрозу пухлини-р (ФНП-Р, лімфотоксин) є одним із перших
описаних цитокінів. Спектри біологічних активностей лімфотоксину і ФНП-а
тотожні. Даний цитокін відіграє важливу роль у протипухлинному і противі
русному імунітеті, а також у процесах імунорегуляції. Клітинами-продуцента-
ми ФНП-Р є активовані Т-лімфоцити (Th 1).
Гранулоцит-макрофаг-колонієстимулюючий фактор альфа (ГМ-КСФ-а)
разом із ІЛ-3 відноситься до ранніх поліпотентних гемопоетичних факторів.
Дата добавления: 2016-08-07; просмотров: 600;
