в історичному аспекті 3 страница
опсонінів, полегшуючи розпізнавання та захоплення патогенів фагоцитами. За
рахунок всього цього формується серозний або гнійний ексудат. Вивільнений
фрагмент С2Ь активує калікреїн-кінінову систему, що сприяє посиленню вазо-
дилатації в осередку, обумовлює появу больових відчуттів, а також викликає
активацію фактора Хагемана (XII чинника зсідання крові), який сприяє роз-
виткові стану гіперкоагуляції у вогнищі запалення. Отже, всі класичні озна-
ки запалення (почервоніння, набряк, біль, підвищення локальної температури
і порушення функції органа) можуть розвиватися внаслідок активації одного
лише комплементу.
Біологічні ефекти системи комплементу:
1. Забезпечення цитолізу об'єктів і бактерицидних властивостей плазми; з цієї
точки зору комплемент доповнює (лат. complementare — доповнювати) дію
лізоциму.
2. Утворення анафілотоксинів (СЗа, С4а та С5а), які індукують вивільнення
гістаміну й інших біологічно активних речовин із опасистих клітин і ба-
зофілів крові, обумовлюючи вазодилатацію, плазморагію, скорочення гла-
денької мускулатури бронхів.
3. Реалізація хемотаксичного впливу на нейтрофіли, еозинофіли і моноцити.
4. Забезпечення адгезії, опсонізації і фагоцитозу.
5. Забезпечення резистентності до вірусів (фрагменти СІ - С9 здатні лізувати
вірус; СЗЬ фрагмент є опсоніном; певні компоненти комплементу блокують
пенетрацію вірусу у клітину).
6. Участь у знешкодженні імунних комплексів, які руйнуються як самим комп-
лементом, так і макрофагами селезінки і печінки, що містять рецептори до
Clq компонента комплементу (звідси - можливість гепато- і спленомегалії
при запаленні).
7. Попередження розвитку аутоагресії при запаленні (за рахунок руйнування
циркулюючих імунних комплексів усувається можливість розвитку імуно-
комплексної патології [гломерулонефриту, васкулітів]).
8. Активація калікреїн-кінінової системи і системи зсідання крові (схема 1).
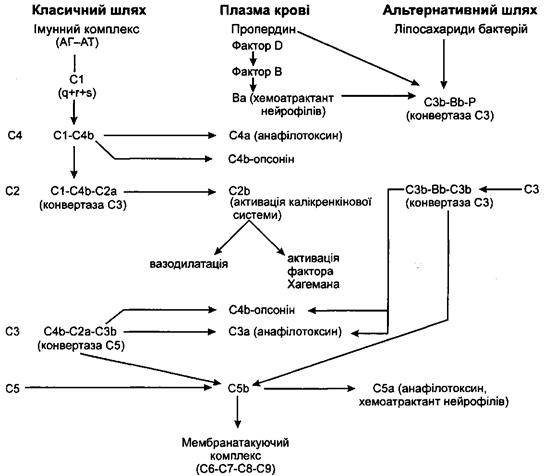
Схема 1. Молекулярний каскад комплементу і його біологічна дія.
На схемі показано, що активація каскаду комплементу (як за класичним, так і за альтерна-
тивним шляхом) призводить не тільки до реалізації безпосереднього пошкоджуючого ефекту
(мембранатакуючі комплекси), але й супроводжується вивільненням великої кількості біоло-
гічно активних фрагментів, які забезпечують розвиток реакції запалення.
Калікреїн-кінінова система. При проникненні чужорідних частинок
(деревини, шматочків скла, кварцу і т.д.) до зовнішніх покривів організму від-
бувається мікропошкодження капілярів, і кров отримує тимчасовий доступ до
патогенного об'єкта. Оскільки чужорідна частинка зазвичай негативно заря-
джена, на ній адсорбується позитивно заряджений фактор Хагемана (ФХ) -
один зі стартових компонентів системи зсідання крові (схема 2). Відомо, що
ще у плазмі крові ФХ спонтанно дисоціює з утворенням невеликої кількості
фрагментів ФХа і ФХб. Саме ФХа, будучи позитивно зарядженою молекулою,
фіксується на поверхні чужорідних частинок. Даний фрагмент має протеолі-
тичну активність, субстратом якої є сам ФХ, а також плазматичний білок пре-
калікреїн. Прекалікреїн під дією ФХа перетворюється на протеазу калікреїн.
Утворений калікреїн різко посилює вивільнення ФХа з ФХ і одночасно діє на
новий субстрат - високомолекулярний кініноген, від якого відщеплює корот-
кий пептид, що отримав назву брадикініну.
Саме брадикінін і є ефекторною ланкою калікреїн-кінінової системи. Він
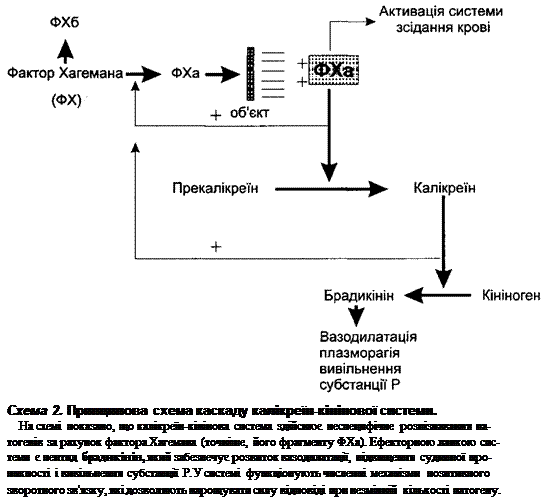
здатен викликати локальну вазодилатацію і підвищення судинної проникності
у вогнищі запалення. Крім того, брадикінін сприяє вивільненню нейромедіа-
тору субстанції Р, яка обумовлює появу больових відчуттів. Завдяки ефекту
брадикініну плазмові фактори (наприклад, лізоцим, комплемент, фагоцити)
надходять до осередку, формуючи гнійний ексудат мікроабсцеса. Вони руйну-
ють мікроорганізми, якими було контаміноване чужорідне тіло, а також нама-
гаються знищити саму частинку. Оскільки найчастіше це неможливо, у мікро-
абсцесі накопичується надмірна кількість ексудату і він проривається назовні.
При цьому чужорідне тіло видаляється з організму. Роль фактора Хагемана
також полягає у відмежуванні осередку запалення за рахунок активації систе-
ми зсідання крові.
Подібно до комплементу, описана система здатна до самопосилення. Це
забезпечується за рахунок формування позитивних зворотних зв'язків. Так,
фіксований на об'єкті ФХа викликає додаткове утворення ФХа з ФХ (схема 2).
Крім того, активований калікреїн також забезпечує розпад ФХ, при якому ви-
вільняється ФХа, здатний додатково фіксуватися на мішені і повторно активу-
вати каскад на той самий патоген.
Надмірна активація системи попереджується за рахунок посиленої про-
дукції інгібіторів протеаз, значна частина яких є гострофазовими білками
(див. нижче).
Оскільки більшість інфекційних агентів - негативно заряджені об'єкти, до
них можливе приєднання фактора Хагемана, що ініціює наступне розгортання
всього каскаду калікреїн-кінінової системи. Крім описаного механізму, кініно-
подібні молекули можуть залучатися до процесів антимікробного захисту при
активації комплементу за класичним шляхом. Як відомо, для цього необхідні
специфічні антитіла. Отже, імунна система здатна повторно активувати калі-
креїн-кінінову систему, забезпечуючи її специфічним механізмом розпізнаван-
ня мікроорганізмів та інших патогенів.
Гострофазові білки - це неоднорідна група білкових субстанцій, що
інтенсивно синтезуються при розвитку гострої фази запалення за принципом
індуцибельної системи генної регуляції. Майже всі вони виробляються ге-
патоцитами під впливом доімунних цитокінів, що продукуються макрофагами
при розпізнаванні патогену (ІЛ-6, а також ІЛ-1(3 і ФНП-а).
Усі гострофазові білки умовно розподілені на три групи (А, Б і В). До
групи А належать церулоплазмін та СЗ-компонент комплементу. При розви-
тку запалення їх вміст у плазмі підвищується на 25-50 %. Групу Б складають
а,-антитрипсин, антихімотрипсин, р2-макроглобулін, гаптоглобін, фібриноген.
У гострій фазі запалення їх рівень зростає у 2-3 рази. І, нарешті, до В-групи
відносять С-реактивний білок, манозозв'язуючий лектин, сироватковий білок
амілоїду А й інтерлейкін 1р\ їх вміст при розвитку запалення зростає більше
ніж у 1000 разів. Такі різнорідні білки об'єднані в єдину групу виходячи з
практичних міркувань - оскільки їх вміст у плазмі крові при розвитку запален-
ня різко зростає, вони використовуються на практиці як лабораторні маркери
запального процесу.
Гострофазові білки суттєво різняться за виконуваною функцією. Так, церу-
л опл азмін відноситься до так званих "антинутрієнтів" - ефективно зв 'язує мідь,
позбавляючи мікроорганізми цього важливого мікроелемента. Сироватковий
амілоїд А використовується для швидкого заповнення дефектів, утворених
внаслідок некротичних процесів при запаленні. Деякі з гострофазових білків є
інгібіторами протеаз (наприклад, о^-антитрипсин, а,-антихімотрипсин і Р2-ма-
кроглобулін). Саме ці агенти інактивують лізосомальні ферменти, вивільнені
зі зруйнованих клітин, нейтралізують протеолітичні ензими, секретовані фаго-
цитами, а також забезпечують коректний ступінь активації калікреїн-кінінової
системи і системи зсідання крові. Гаптоглобін здійснює зв'язування гемогло-
біну, зменшуючи його патологічні втрати в умовах запалення, а фібриноген
при ексудації в периваскулярний простір утворює фібринові згустки, які пере-
шкоджають швидкому розповсюдженню запального процесу.
Таким чином, перераховані гострофазові білки виконують протективну
роль, максимально обмежуючи самопошкодження при запаленні, забезпечу-
ючи найбільш прицільне, а значить, і економне використання інших факторів
природженого імунітету.
Разом з тим існують білки гострої фази, задіяні у реалізації ефекторних
механізмів природженого імунітету. Найбільш вивченими з них є С-реактив-
ний білок (СРБ) та манозозв'язуючий протеїн (МЗП). Обидва фактори ма-
ють принаймні дві властивості, що визначають їх протимікробну активність,
- здатність до опсонізації та активації комплементу.
Так, С-реактивний протеїн є своєрідним прототипом антитіла і має висо-
ку тропність до фосфорилхоліну та подібних молекул, що широко представ-
лені серед поверхневих структур мікроорганізмів. Такі молекули містяться і
на власних клітинах організму, але їх надійно екрановано від розпізнавання.
Зв'язавшись з наведеною молекулою, С-реактивний білок може виступати в
якості опсоніну, полегшуючи розпізнавання інфекційного агенту фагоцитами,
або активувати систему комплементу за класичним шляхом. Справа в тому, що
даний фактор здатний зв'язувати Clq компонент комплементу з наступним за-
лученням всього каскаду і формуванням мембранатакуючих комплексів.
Відомо, що вміст СРБ різко зростає при аутоімунній патології (зокрема,
системних захворюваннях сполучної тканини). Побутує хибна думка, що
СРБ сприяє аутоімунній агресії, хоча насправді він покликаний обмежувати
її. Встановлено, що С-реактивний білок здійснює опсонізацію і обумовлює
подальше руйнування екстраклітинної ДНК і клітинного детриту, які можуть
стати причиною аутоімунної атаки ({'scavenger function"). Окрім того, СРБ
здійснює екранування найбільш поширених аутоантигенних детермінант спо-
лучної тканини (фібронектин, ламінін, полікатіонні поверхні колагену, ліпо-
протеїни низької і дуже низької густини). Зв'язуючись з наведеними ліганда-
ми, СРБ виконує роль своєрідного "пластиру", який прикриває аутоантигени
від розпізнавання і презентації, або забезпечує їх подальше руйнування, що
призводить до втрати антигенних властивостей.
Манозозв'язуючий протеїн є лектином і взаємодіє із залишками манози
на поверхні клітинних стінок бактерій, опсонізуючи їх для фагоцитозу моноци-
тами. Макрофаги, які є більш зрілими клітинами, мають власний манозозв'язу-
ючий рецептор на зовнішній плазматичній мембрані. МЗП працює разом з так
званими лектин-асоційованими протеазами 1 і 2. Приєднання цього фактору до
мікробних лігандів активує протеази, які розщеплюють С2 та С4 компоненти
комплементу. Продукти розщеплення (С2а та С4Ь) формують фермент СЗ-кон-
вертазу, яка ініціює подальший молекулярний каскад комплементу. Отже, комп-
лекс манозозв'язуючого протеїну та його лектин-асоційованих протеаз є анало-
гом СІ компоненту класичного шляху активації комплементу. Але при цьому
залучення комплементу відбувається без участі імунних комплексів, а значить,
розпочинається одразу ж після надходження інфекційного агента до організму.
Останнім часом виявлена важлива роль МЗП в аутоімунних реакціях.
Низька експресія цього білка може розглядатися як фактор ризику СЧВ, що
пов'язано з порушенням кліренсу імунних комплексів, що утворюються при
будь-якій інфекції. З іншого боку, МЗП відіграє провідну роль в аутоагресії
при ревматоїдному артриті (РА). Відомо, що причиною розладів при РА є син-
тез дефектного IgG, який не містить залишку галактози. МЗП взаємодіє з ви-
вільненими у такому разі N-ацетилглюкозаміновими групами антитіл (IgG),
провокуючи тим самим комплемент-опосередковану аутоагресію.
Природні антитіла синтезуються постійно, навіть за відсутності анти-
генної стимуляції (апріорно). Вважають, що синтез природних антитіл здій-
снюють так звані Bj-лімфоцити. За рахунок діяльності цих клітин створюєть-
ся пул імуноглобулінів, що містить антитіла практично до будь-якого типового
антигену патогенних мікроорганізмів ще до моменту антигенної стимуляції.
Такі антитіла належать до IgM і є поліреактивними, у зв'язку з чим мають
низьку спорідненість до антигенів. їх функція полягає у негайному зв'язуванні
певної кількості патогенів у той час, коли ще не відбувається синтез специфіч-
них антитіл. При цьому природні антитіла виступають у ролі опсонінів або
активують комплемент за класичним шляхом.
Інтерферони. Існує щонайменше 14 інтерферонів-а (продуктів лейко-
цитів), кілька різновидів інтерферонів-р (продуктів фібробластів) і інтерфе-
рон-у, який синтезується Т-хелперами 1 типу і природними кілерами. Основне
призначення інтерферонів а і Р полягає у захисті від вірусів. При вірусній ін-
фекції уражені клітини синтезують зазначені інтерферони, які надходять до
міжклітинного простору і зв'язуються з рецепторами сусідніх, не уражених
вірусом клітин. Це призводить до активації генів, що відповідальні за синтез
специфічних білків, які інгібують транскрипцію вірусної нуклеїнової кислоти.
Паралельно відбувається продукція протеїнкіназ, що знижують трансляцію
мРНК вірусу, пригнічуючи синтез білків капсиду. Також інтерферони а і р ак-
тивують латентну ендонуклеазу, яка призводить до деградації РНК (як вірусу,
так і клітини-хазяїна). Отже, зазначені інтерферони діють на всіх трьох рівнях
синтезу білка - на власне вірусну РНК як носія генетичної інформації, на про-
цеси транскрипції і трансляції. Результат дії інтерферону полягає в утворенні
навколо осередку ураження бар'єра із клітин, які не здатні забезпечити репро-
дукцію вірусу.
Інтерферон-у виконує функції спеціального цитокіну і має обмежену пря-
му противірусну активність. Однак він здатен активувати природні кіл ери, ци-
тотоксичні Т-лімфоцити і макрофаги, які беруть безпосередню участь у руйну-
ванні вірусінфікованих клітин.
Встановлено протипухлинний, а також антибактеріальний ефекти інтер-
феронів.
Ендогенні пептиди-антибіотики. В людському організмі синтезу-
ються пептиди, що мають властивості антибіотиків. Найбільш вивченими є так
звані дефензини, які розділяються на 2 групи (о і Р). а-дефензини містяться в
гранулах нейтрофілів, а Р-дефензини синтезуються епітеліоцитами дихальних
шляхів та шлунково-кишкового тракту. За хімічними властивостями дефензи-
ни поділяються на гідрофільні і ліпофільні. Принцип дії цих антимікробних
пептидів полягає у вбудовуванні у клітинні мембрани бактерій або оболонки
складних вірусів, що призводить до порушення цілісності поверхневих струк-
тур атакованих патогенів.
Ейкозаноїди. При запаленні у мембранах багатьох активованих клітин
вмикається фермент фосфоліпаза А^, яка вилучає арахідонову (ейкозотетрає-
нову) кислоту із фосфоліпідного бішару. В подальшому з цієї поліненасиченої
жирної кислоти синтезуються так звані ейкозаноїди - простагландини (впер-
ше виявлені в тканині простати) і лейкотрієни, які виступають у ролі медіато-
рів запалення. У випадку залучення ферменту циклооксигенази (циклоокси-
геназний шлях) з арахідонової кислоти утворюються простагландини, а у разі
активації ліпооксигенази (ліпооксигеназний шлях) - лейкотрієни (схема 3).
При запаленні першими вивільняються лейкотрієни, а пізніше активується
синтез простагландинів. Слід зазначити, що ейкозаноїди є поліфункціональ-
ними сполуками, призначення яких не обмежується лише обслуговуванням за 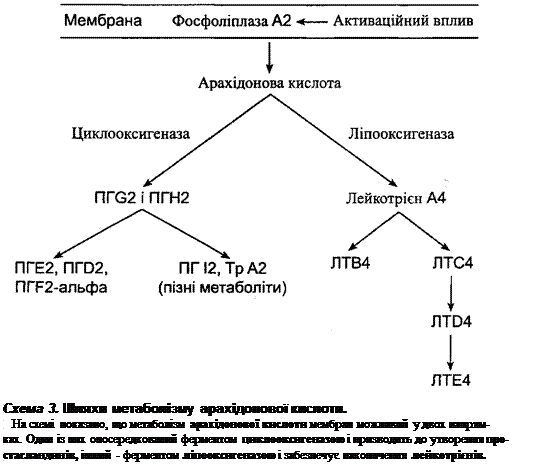
палення. Так, простагландини нирок беруть участь у регуляції системного ар-
теріального тиску, виступаючи у ролі депресорних факторів. Біологічні ефекти
ейкозаноїдів при запаленні можна звести до вазоактивної (більше виражена у
простагландинів), хемотаксичної (більше притаманна лейкотрієнам) та імуно-
регуляторної дії. Ейкозаноїди здатні чинити різний вплив на мікроциркуляцію.
В цілому вони викликають розширення артеріол і звуження венул, що сприяє
гіперемії осередку їх вивільнення. Крім того, вони потенціюють ефекти БАР
(наприклад, гістаміну), які підвищують судинну проникність. Ці сполуки ви-
являють хемотаксичний вплив на клітини природженої резистентності (ней-
трофіли, моноцити) і тому сприяють розвитку клітинної інфільтрації вогнища.
Встановлено також, що ейкозаноїди пригнічують проліферацію зрілих імуно-
компетентних клітин, але стимулюють дозрівання молодих лімфоцитів. Отже,
ці сполуки не пригнічують імунну відповідь, а тільки затримують залучення
імунокомпетентних клітин до запалення, надаючи час факторам природженої
резистентності для роботи з патогеном.
Суттєва роль належить ейкозаноїдам у регуляції активності макрофагів.
Встановлено, що макрофаг здатен синтезувати простагландин Е2 (ПгЕ2), який
пригнічує фагоцитарну активність клітини-продуцента (аутокринний меха-
нізм) або поруч розташованих макрофагів (паракринний механізм). Лейкотрієн
В4, що продукується за тими ж принципами, стимулює фагоцитарну актив-
ність макрофагів. Крім того, ПгЕ2, синтезований макрофагом, пригнічує про-
ліферацію Т-хелперів, що, напевно, забезпечує негативний зворотний зв'язок
при взаємодії цих клітин під час реалізації реакцій цитотоксичності.
Складність дослідження біологічних ефектів ейкозаноїдів полягає у тому,
що їх дія змінна - вони схильні до потенціації ефектів тих медіаторів, висо-
ка концентрація яких досягнута на момент вивільнення ейкозаноїду. Зокрема,
простагландин Е2 зазвичай викликає дилатацію бронхів, проте у разі вивіль-
нення на фоні дії повільнореагуючої субстанції анафілаксії (комплекс лей-
котрієнів С4, D4, Е4) суттєво посилює бронхоконстрикторний ефект останньої.
До пізніх продуктів циклооксигеназного шляху належать простациклін
(ПгІ2) та тромбоксан А2 (ТрА2), які регулюють мікроциркуляцію. Простациклін
синтезується ендотелієм і викликає вазодилатацію та зниження агрегацій-
них властивостей тромбоцитів, покращуючи реологічні властивості крові.
Тромбоксан А2 вивільняється тромбоцитами, сприяє посиленню агрегаційної
здатності крові, викликає вазоспазм. При запаленні зазвичай активується син-
тез простацикліну, оскільки більшість БАР викликають вазодилатацію посе-
редництвом саме цього регулятора. Проте у разі високої концентрації тром-
боцитактивуючого фактора (ТАФ; англ. Platelet activating factor, PAF),
який синтезується опасистими клітинами і гранулоцитами, рівновага у системі
ПгІ2 - ТрА2 зміщується в бік тромбоксану. ТАФ активує нейтрофіли, розши-
рює судини і спазмує бронхи, а також сприяє вивільненню БАР із тромбоцитів
(тромбоксану А2, серотоніну, адреналіну та інших).
2.2. Клітинні фактори природженого імунітету
Система фагоцитів представлена двома типами клітин: макрофагами
(похідними моноцитів крові) і мікрофагами (нейтрофільними гранулоцитами).
Клітини моноцитарно-макрофагальної системи виконують в організмі по-
двійну функцію: беруть участь у запуску та регуляції механізмів імунітету та у
процесах безпосереднього захисту організму від чужорідних агентів.
Макрофаги (рис. 3). Основною властивістю макрофагів є здатність до
фагоцитозу - селективного ендоцитозу та подальшої деструкції об' єктів, якщо
останні містять патогензв'язані молекулярні шаблони або приєднані опсоніни.
Для виявлення таких об'єктів макрофаги мають на своїй мембрані рецептори
шаблонного розпізнавання (зокрема, манозозв'язуючий рецептор і рецептор
до ліпополісахаридів), а також рецептори до опсонінів (зокрема, до третього
компонента комплементу [СЗЬ], до Fc-фрагментів імуноглобулінів).
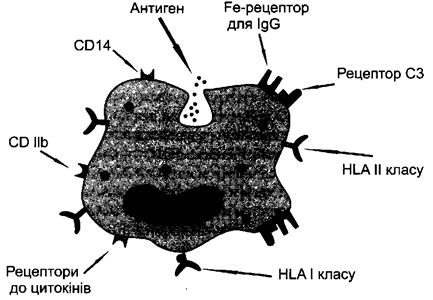
Рис. 3. Поверхневі молекули макрофагу.
На рисунку продемонстровано, що макрофаг містить достатньо багатий арсенал поверх-
невих структур. Одні з них сприяють ефективнішому розпізнаванню об'єктів для фагоцитозу
(рецептори до Fc-фрагментів антитіл і СЗЬ-компонента комплементу), інші - необхідні
для здійснення антигенної презентації (молекули HLA II класу), а треті забезпечують адге-
зійні властивості клітини (CDllb і CDllc) та її чутливість до регуляторних впливів (рецеп-
тори до цитокінів).
Фагоцитований макрофагом об'єкт зазнає подальшого розщеплення (про-
цесингу) за рахунок факторів агресії, що накопичуються у фаголізосомі кліти-
ни. Так, тут міститься близько 60 гідролітичних ферментів, здатних опосеред-
ковувати реакції руйнування мікробних структур. Однак зазначені ферменти не
можуть розщеплювати цілісні об'єкти, наприклад, бактеріальну клітину, а здат-
ні працювати тільки з їх фрагментами. Отже, для ефективного ферментативно-
го розщеплення патоген має зазнати попередньої деструкції. Така деструкція
патогену досягається за рахунок залучення потужних неферментативних фак-
торів агресії, до яких належать активні метаболіти кисню, що утворюються
в результаті так званого "кисневого вибуху", а також галогенвмісні бактери-
цидні речовини, активні азотисті метаболіти та допоміжні субстанції - лізоцим та лактоферин. Лізоцим здійснює руйнування клітинних стінок грам-
позитивних бактерій, а лактоферин зв'язує залізо, перешкоджаючи його надхо-
дженню до мікроорганізму, а також сприяє перебігу гідролітичних процесів.
Відмічено, що при фагоцитозі об'єкта різко збільшується споживання ма-
крофагом глюкози - енергетичного матеріалу, необхідного для накопичення
достатньої кількості НАДФ-Н-оксидази, з діяльністю якої і пов'язано утво-
рення стартового активного метаболіту кисню - супероксид-аніона (02~).
Супероксид-аніон - це молекула кисню, яка містить неспарений електрон та
вільну валентність, тобто є вільним радикалом - надзвичайно реакційноздат-
ним агентом. У подальшому спонтанно (або за рахунок діяльності суперок-
сиддисмутази) відбувається так звана дисмутація супероксид-аніона з утво-
ренням перекису водню (Н202). При взаємодії певної частини молекул ново-
утвореного перекису водню з вільними супероксид-аніонами утворюються ще
два метаболіти - гідроксильний радикал (ОН) та синглетний кисень (О,
або Ю2). Отже, основними токсичними сполуками кисню, що накопичуються
у фаголізосомах макрофагів, є перекис водню, гідроксильний радикал і син-
глетний кисень, а супероксидний аніон є стартовим метаболітом, що ініціює
реакції вільнорадикального окислення.
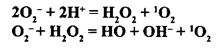
Наведені реакції демонструють утворення основних активних кисневих продуктів макро-
фагів - перекису водню, синглетного кисню та гідроксильного радикалу.
Зазначені реакції здійснюються за принципом ланцюгових - утворення
певної кількості вільних радикалів супроводжується активним окисленням
будь-яких хімічних зв'язків (навіть стабільних за звичайних умов) з форму-
ванням ще більшої кількості нових вільних радикалів, які моментально залу-
чаються до хімічних реакцій. При цьому кількість активних молекул кисню
зростає у геометричній прогресії. Гіпотетично, такий процес може тривати
до нескінченності, тому активація лише одного макрофагу потенційно може
призвести до руйнування не тільки захопленого патогену, але й до загибелі
макроорганізму в цілому. Проте макрофаг містить так звану антиоксидантну
систему, що знешкоджує надлишок вільних радикалів, перетворюючи їх до
відносно безпечних метаболітів. Так, та ж сама супероксиддисмутаза здатна
перетворювати супероксид-аніон до молекули води та кисню (при взаємодії
його з іонами водню), фермент каталаза розщеплює перекис водню. Фермент
глутатіонредуктаза задіяний у нейтралізації гідроксильних радикалів. Таким
чином підтримується тонкий баланс між прооксидантними та антиоксидант-
ними системами.
Галогенвмісні бактерицидні метаболіти (зокрема, ОСІ" та ОР) утворюють-
ся за рахунок діяльності ферменту мієлопероксидази, що каталізує взаємодію
галогенів з Н202. За рахунок діяльності NO-синтази синтезуються оксид азоту
(NO) та його вільний радикал (NO"). Активація NO-синтази здійснюється зде-
більшого при дії на макрофаг інтерферону-у, чим пояснюється антибактері-
альна активність інтерферону.
В подальшому до процесів руйнування захопленого патогену залучаються
гідролітичні ферменти - протеази, ліпази й ензими, які розщеплюють вуглево-
ди. В мембрані фаголізосоми активно працюють водневі помпи, що переносять
Н+ всередину органели. Зниження рН різко зменшує резистентність фагоцито-
ваного мікроорганізму, а також підвищує активність гідролітичних ферментів.
Поки відбувається руйнування захопленого об'єкту, на мембрані макрофа-
га суттєво зростає кількість рецепторів шаблонного розпізнавання і рецепторів
до опсонінів, що дозволяє продовжувати здійснення фагоцитозу; а також під-
вищується експресія молекул головного комплексу гістосумісності II класу, які
залучаються до процесу презентації антигену імунокомпетентним клітинам.
Активований макрофаг синтезує комплект так званих доімунних цитокінів
(інтерлейкіну ір [ІЛ-ір], інтерлейкіну 6 [ІЛ-6] і фактору некрозу пухлини
а [ФНП-а]), які залучають до роботи інші фагоцити і активують імунокомпе-
тентні клітини, готуючи їх до розпізнавання антигену. Рештки патогену вида-
ляються з макрофагу шляхом екзоцитозу, а його імуногенні пептиди надходять
у комплексі з молекулами HLA II класу на поверхню клітини для активації
Т-хелперів, тобто підтримання імунної відповіді.
Окрім цього, на своїй мембрані макрофаги експресують інші рецептори,
які забезпечують процеси адгезії (CDllc і CD lib), сприйняття регуляторних
впливів (рецептори до цитокінів), а також участь у міжклітинній взаємодії. Так,
є рецептори до різних лімфокінів, гормонів, біологічно активних речовин.
Добре відома провідна роль макрофагів у так званому асептичному запа-
ленні, яке розвивається в осередках неінфекційного некрозу клітин (наприклад,
ішемічного). Завдяки експресії рецепторів до сміття {scavenger receptor) ці клі-
тини ефективно фагоцитують і знешкоджують елементи тканинного детриту.
Встановлено, що саме макрофаги здійснюють захоплення і знешкодження
сторонніх частинок (пилу, частинок металу тощо), які з різних причин потра-
пили до організму. Проблема розпізнавання таких об'єктів полягає у тому, що
вони абсолютно позбавлені молекулярних шаблонів і не фіксують опсонінів.
Для виходу з цієї важкої ситуації макрофаги вдаються до наступного прийому.
Вони розпочинають синтез компонентів міжклітинного матриксу (фібронек-
тину, протеогліканів та інших), якими вкривають частинку. За рахунок цього
макрофаги штучно створюють такі її поверхневі структури, які здатні забез-
печити належне розпізнання і фагоцитоз.
Важлива роль макрофагів у перебудові метаболізму при запаленні. Так,
ФНП-а, продукований ними, активує ліпопротеїнліпазу, яка викликає мобіліза-
цію ліпідів із депо і при тривалому запаленні обумовлює схуднення. Той самий
цитокін пригнічує синтез гепатоцитами альбумінів і разом з макрофагальним
ІЛ-6 посилює продукцію ними гострофазових білків, які відносяться переваж-
но до глобулінової фракції. Збільшення їх продукції поряд із інтенсивним син-
тезом антитіл (імуноглобулінів) викликає зниження альбуміново-глобуліново-
го коефіцієнту і підвищення показників тимолової проби при запаленні.
Отже, макрофаги і моноцити виконують наступні функції:
1. Здійснюють фагоцитоз.
2. Забезпечують процесинг антигенів і подальшу презентацію їх імуногенних
Дата добавления: 2016-08-07; просмотров: 1381;
