в історичному аспекті 2 страница
нізмів середовища існування. Проблема полягає в тому, що кожний організм
має обмежену кількість генів, які містяться в його геномі. Людський геном,
наприклад, містить близько 25 000 генів, більшість з яких не мають жодного
відношення до імунного розпізнавання. Разом з тим, існує надзвичайно велика
КІЛЬКІСТЬ різноманітних мікробних антигенів. При цьому загальна кількість
рецепторів, що задіяні у природжених механізмах розпізнавання, вираховуєть-
ся лише сотнями. Окрім того, не слід забувати, що мікроорганізми надзвичай-
но різноманітні і можуть видозмінюватися набагато частіше, ніж будь-який з
їх хазяїнів. Отже, геном людини є недостатньо потужною системою для забез-
печення достатнього репертуару рецепторів до всіх можливих антигенів. Тому
природжені механізми резистентності, ґрунтуючись на спадковому матеріалі,
не в змозі розпізнати кожний можливий антиген, а зосереджуються лише на
найбільш розповсюджених типових (шаблонних) структурах. Такі структури
називають патогензв'язаними молекулярними шаблонами, а рецептори до
них - рецепторами шаблонного розпізнавання.
До найтиповіших патогензв'язаних молекулярних шаблонів належать бак-
теріальні ліпополісахариди, пептидоглікани, ліпотейхоєві кислоти, мана-
ни, бактеріальна ДНК, двоспіральна РНК, глюкани. Хоча наведені струк-
тури значно різняться за хімічною будовою, всі вони мають певні спільні влас-
тивості. По-перше, такі молекули продукуються тільки патогенними мікроор-
ганізмами, але не їх хазяїнами. Наприклад, ліпополісахариди певної структури
синтезуються лише бактеріями, а тому взаємодія рецепторів шаблонного роз-
пізнавання з такими ліпополісахаридами сигналізує макроорганізмові саме про
бактеріальне вторгнення. По-друге, патогензв'язані шаблони є життєво важли-
вими структурами для збудника або визначають його патогенність. У зв'язку
з цим останній не може позбавитись від таких молекул для уникнення розпіз-
навання. І, нарешті, зазначені структури є інваріантними, тобто присутніми у
всіх представників певних класів патогенних мікроорганізмів. Наприклад, всі
грамнегативні бактерії містять типові ліпополісахариди, а тому відповідний
рецептор шаблонного розпізнавання хазяїна здатен встановити факт присут-
ності в організмі будь-якої грамнегативної бактерії, хоча й не може визначити
її більш точну природу.
Рецептори шаблонного розпізнавання. Рецептори шаблонного розпіз-
навання містяться на професійних антигенпрезентуючих клітинах, до яких
належать макрофаги, дендритні клітини та В-лімфоцити. Важливо зазначити, що експресія таких рецепторів не є клональною. Це означає, що всі ре-
цепторні молекули на клітинах одного типу (наприклад, на макрофагах) мають
ідентичні властивості. Нагадаємо, що рецептори антигенного розпізнавання
імунокомпетентних клітин різних клонів суттєво різняться за структурою ан-
тигензв'язуючого сайту.
Як тільки рецептори шаблонного розпізнавання ідентифікують пато-
гензв'язаний молекулярний шаблон, одразу ж запускаються ефекторні клітини
для виконання своїх функцій. Цей факт пояснює високу кінетику механізмів
природженої резистентності.
Функціонально рецептори шаблонного розпізнавання поділяються на три
класи: секреторні, клітинні і сигнальні. Секреторні рецептори шаблонного
розпізнавання функціонують в якості опсонінів, зв'язуючись з поверхневими
структурами мікробів і позначаючи їх для розпізнавання системою компле-
менту і фагоцитами. Слід зазначити, що опсонінами називають своєрідні біо-
логічні "мітки", які, приєднуючись до різноманітних антигенних субстанцій,
полегшують їх подальше розпізнавання (а значить, і знешкодження) факто-
рами природженої резистентності. Найбільш відомий секреторний рецептор
шаблонного розпізнавання - манозо-зв'язуючий лектин (лектин - це білок,
здатний зв'язувати вуглеводи), який синтезується в печінці і циркулює у плазмі
крові. Цей білок належить до кальцій-залежної родини лектинів і функціонує
як компонент так званої гострофазової реакції (див. "Структура і функціональ-
не призначення окремих компонентів природженого імунітету").
Клітинні рецептори шаблонного розпізнавання перебувають на поверхні
фагоцитів. Якщо такі рецептори розпізнають на мікробній клітині відповідний
патогензв'язаний молекулярний шаблон, відбувається захоплення носія ша-
блонів фагоцитуючою клітиною з формуванням фагосоми. В подальшому така
фагосома зливається з лізосомою з утворенням фаголізосоми, де здійснюєть-
ся ферментативна і вільнорадикальна деструкція патогену. В такому випад-
ку патогенпохідні пептиди можуть бути представлені молекулою головного
комплексу гістосумісності (HLA) II класу на поверхні макрофага (або іншої
антигенпрезентуючої клітини) для розпізнавання специфічними рецепторами
імунокомпетентних клітин.
Манозозв'язуючий лектин поверхні макрофагу є типовим прикладом клі-
тинного рецептора шаблонного розпізнавання. Цей білок розпізнає поверхневі
вуглеводи з високим вмістом маноз, наявність яких є характерною ознакою для
бактеріальних і грибкових мікроорганізмів. У подальшому він забезпечує фа-
гоцитоз розпізнаного патогену макрофагами. Інший клітинний рецептор ша-
блонного розпізнавання макрофагів - так званий фагоцитарний рецептор до
ліпополісахаридів (rLPS). rLPS зв'язується з ліпополісахаридами клітинних
стінок бактерій, що забезпечує їх розпізнавання і подальше знешкодження.
Сигнальні рецептори шаблонного розпізнавання при взаємодії з мікро-
бними шаблонами активують внутрішньоклітинні молекулярні каскади, які
стимулюють експресію багатьох генів імунної відповіді, що кодують структу-
ру прозапальних субстанцій. Зокрема, до цього класу належать так звані toll-
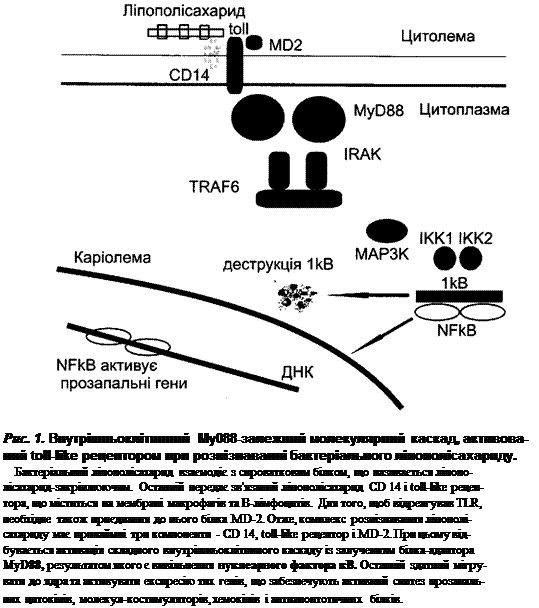
like рецептори (TLR). Розшифровано сигнальний шлях, що запускається та-
кими рецепторами після розпізнавання бактеріальних ліпополісахаридів (рис.
1). Сьогодні відомо 11 різновидів TLR антигенпрезентуючих клітин, які здатні
розпізнавати шаблонні структури мікроорганізмів (бактерій, вірусів, грибків),
найпростіших, рослин і навіть власного організму (таблиця 1).

Таблиця 1.

Цитоплазматичний каскад, який вмикається активованим TLR, може роз-
гортатися як за Му088-залежним (рис. 1), так і за МуБвв-незалежним шля-
хом. MyD88 є білком, який адаптує#різні TLR до ідентичного цитоплазматич-
ного молекулярного каскаду клітин, у зв'язку з чим отримав назву білка-адап-
тора. В першому випадку (TLR1, TLR2, TLR4, TLR5, TLR6, TLR7, TLR9) кін-
цевим результатом реалізації каскаду є вивільнення потужного прозапального
посередника - нуклеарного фактору кВ (NF-кВ), який забезпечує синтез до-
імунних цитокінів (ФНП-а, ІЛ-lp, ІЛ-6, ІЛ-12), стрес-білків, костимуляційних
молекул (CD80, CD86, CD40), хемокінів (зокрема ІЛ-8), антиапоптотичних
білків (див "Апоптоз як регулятор імунної відповіді"). При реалізації MyD88-
незалежного шляху (TLR3 і TLR4) кінцевим результатом є синтез ІФН а/р і
костимуляційних молекул.
Отже, вже на рівні системи природженої резистентності має місце дифе-
ренціальний підхід до типу відповіді при різних формах патогенів. Так, при
позаклітинних патогенах (насамперед, бактерії) реалізується МуБ88-залеж-
ний шлях активації клітини, а при внутрішньоклітинній інфекції (насамперед,
віруси) - МуБ88-незалежний.
Природжене розпізнавання та контроль імунної відповіді. Як вказува-
лося раніше, імунна система має величезний обсяг рецепторів для розпізна-
вання практично будь-якого антигена. Проте у зв'язку з тим, що рецептори
антигенного розпізнавання генеровані навмання, деякі з них здатні специфіч-
но зв'язуватися з інертними субстанціями навколишнього середовища або зі
структурами власного організма (так званими аутоантигенами). Цілком зро-
зуміло, що реакції імунної системи на аутоантигени є неприпустимими. Тому
захисні процеси організовано таким чином, що імунокомпетентні клітини
зазвичай не можуть самостійно розпізнати антиген. При цьому активацією
власне імунних реакцій керують сигнали, викликані розпізнаванням антигену
природженими механізмами резистентності. Це означає, що імунна система
реагує на хвороботворний мікроорганізм тільки після розпізнавання його фак-
торами природженої резистентності.
Наприклад, Т-лімфоцити використовують свої рецептори антигенного роз-
пізнавання для зв'язування з лігандом у вигляді імуногенного пептиду в комплексі з молекулою HLA II класу на мембрані антигенпрезентуючих клітин, які
належать до природжених факторів захисту. Розпізнавання антигену такими
факторами є надійним, тому що їх рецептори не згенеровано випадковим чи-
ном, вони грунтуються на спадковому матеріалі і спрямовані виключно про-
ти стабільних структур патогенних агентів (патогензв'язаних молекулярних
шаблонів). Однак розпізнавання природженими механізмами резистентності
має суттєві недоліки, пов'язані з обмеженою кількістю генів, які кодують їх
рецептори (недостатній об'єм геному людини). У зв'язку з цим зазначені меха-
нізми здатні розпізнати досить обмежену кількість найбільш розповсюджених
(шаблонних) структур інфекційних агентів. Весь антигенний арсенал збудника
можна розпізнати лише за рахунок власне імунних реакцій, оскільки імуноком-
петентні клітини містять практично необмежену різноманітність рецепторів ан-
тигенного розпізнавання. А це означає, що найбільш адекватний захист проти
конкретного патогену забезпечують саме механізми із залученням лімфоцитів.
Зважаючи на наведені дані, слід розуміти, що імунокомпетентні клітини не
вміють відрізняти "своє" від "чужого", оскільки їх рецепторний апарат не від-
биває специфіки геному організму. Тому для коректної імунної відповіді вони
потребують активації з боку факторів природженої резистентності. Як зазна-
чалося, рецептори антигенного розпізнавання Т-лімфоцитів здатні взаємодіяти
з антигеном, якщо його подано у вигляді імуногенного пептида в комплексі з
молекулою HLA II класу на мембрані антигенпрезентуючої клітини (макрофа-
га, дендритної клітини або В-лімфоцита). Експресія молекули головного комп-
лексу гістосумісності вказує імунокомпетентній клітині на те, що інформація
про антиген отримується від власної клітини, тобто є вірогідною.
Однак фагоцити можуть захоплювати і презентувати компоненти власних
тканин (при руйнуванні старих клітин, при запальних процесах), що не ви-
ключає можливості аутоімунних реакцій. У зв'язку з цим захисні системи ор-
ганізовано таким чином, що описана взаємодія є недостатньою для активації
імунокомпетентної клітини. Навпаки, якщо взаємодія між антигенпрезентую-
чою клітиною та Т-лімфоцитом обмежиться лише наведеними компонентами,
то імунокомпетентна клітина зазнає апоптозу (запрограмованої загибелі). Для
уникнення апоптозу Т-лімфоцита необхідна додаткова взаємодія між власною
молекулою CD28 і CD80 (або CD86) АПК, тобто отримати так званих кости-
муляційних сигналів. Встановлено, що TLR стимулюють появу таких молекул
на поверхні антигенпрезентуючих клітин після взаємодії з патогензв'язаними
шаблонами. Оскільки патогензв'язані шаблони містять лише патогенні мікро-
організми, TLR стимулюють появу CD80 та CD86 лише за умови присутності
інфекції. Власні антигени не розпізнаються рецепторами природженої резис-
тентності і тому не стимулюють експресію CD80. Такий механізм гарантує
активацію лише патоген-специфічних Т-лімфоцитів, а аутореактивні клітини
(якщо такі вижили після дозрівання в тимусі) перебувають у стані анергії і
протягом свого існування не вступають в дію.
Резюме. Випадкова генерація надзвичайно різноманітного репертуару ре-
цепторів антигенного розпізнавання дозволяє імунній системі розпізнавати і
специфічно реагувати практично на будь-який антиген. Проте ціна такої різно-
манітності - нездатність відрізнити чужорідні антигени від власних, реакція
проти яких є неприпустимою. У той же час система природженої резистент-
ності продукує досить обмежену кількість рецепторів, які є специфічними
для стабільних (шаблонних) мікробних структур. Розпізнавання цих структур
факторами природженого захисту спричиняє появу костимуляторів, продук-
цію прозапальних цитокінів, хемокінів і антиапоптотичних білків, які сприя-
ють розвиткові запалення і залучають антигенспецифічні лімфоцити до імун-
ної відповіді.
2. Структура і функціональне призначення окремих
компонентів природженого імунітету
До компонентів системи природженого імунітету належать клітинні і гу-
моральні фактори, вказані в таблиці 2.
Таблиця 2.
Гуморальні і клітинні фактори природженого імунітету
| Гуморальні фактори: | Клітинні фактори: |
| - лізоцим; | - нейтрофіли; |
| - комплемент; | - моноцити; |
| - доімунні цитокіни (ІФН а/р, ФНП-а, | - макрофаги; |
| ІЛ-ір, ГМ-КСФ та інші); | - природні кілери; |
| - калікреїн-кінінова система; | - дендритні клітини; |
| - фактор Хагемана; | - еозинофіли; |
| - природні антитіла; | - базофіли крові; |
| - гострофазові білки; | - опасисті клітини; |
| - пептиди-антибіотики; | - тромбоцити; |
| - ейкозаноїди; | - еритроцити |
| - тромбоцитактивуючий фактор |
2.1. Гуморальні фактори природженого імунітету
Гуморальні фактори системи природженої резистентності є групою білків
і поліпептидів, які секретуються різними клітинами організму. Вони можуть
бути умовно поділені на крупномолекулярні білки, що мають ферментативну
(якщо такі вижили після дозрівання в тимусі) перебувають у стані анергії і
протягом свого існування не вступають в дію.
Резюме. Випадкова генерація надзвичайно різноманітного репертуару ре-
цепторів антигенного розпізнавання дозволяє імунній системі розпізнавати і
специфічно реагувати практично на будь-який антиген. Проте ціна такої різно-
манітності - нездатність відрізнити чужорідні антигени від власних, реакція
проти яких є неприпустимою. У той же час система природженої резистент-
ності продукує досить обмежену кількість рецепторів, які є специфічними
для стабільних (шаблонних) мікробних структур. Розпізнавання цих структур
факторами природженого захисту спричиняє появу костимуляторів, продук-
цію прозапальних цитокінів, хемокінів і антиапоптотичних білків, які сприя-
ють розвиткові запалення і залучають антигенспецифічні лімфоцити до імун-
ної відповіді.
2. Структура і функціональне призначення окремих
компонентів природженого імунітету
До компонентів системи природженого імунітету належать клітинні і гу-
моральні фактори, вказані в таблиці 2.
Таблиця 2.
Гуморальні і клітинні фактори природженого імунітету
| Гуморальні фактори: | Клітинні фактори: |
| - лізоцим; | - нейтрофіли; |
| - комплемент; | - моноцити; |
| - доімунні цитокіни (ІФН <х/р, ФНП-а, | - макрофаги; |
| ІЛ-1р, ГМ-КСФ та інші); | - природні кілери; |
| - калікреїн-кінінова система; | - дендритні клітини; |
| - фактор Хагемана; | - еозинофіли; |
| - природні антитіла; | - базофіли крові; |
| - гострофазові білки; | - опасисті клітини; |
| - пептиди-антибіотики; | - тромбоцити; |
| - ейкозаноїди; | - еритроцити |
| - тромбоцитактивуючий фактор |
2.1. Гуморальні фактори природженого імунітету
Гуморальні фактори системи природженої резистентності є групою білків
і поліпептидів, які секретуються різними клітинами організму. Вони можуть
бути умовно поділені на крупномолекулярні білки, що мають ферментативну
активність (лізоцим, компоненти комплементу), речовини, які зв'язують необ-
хідні для бактерій нутрієнти - так звані антинутрієнти (лактоферин, трансфе-
рин, церулоплазмін), сполуки, спрямовані проти певних складових мікробів
або їх продуктів (колектини [манозозв'язуючий протеїн], пентраксини [С-ре-
активний білок], сироваткові попередники амілоїду й інші), а також порівня-
но дрібномолекулярні поліпептиди (менше 100 амінокислотних залишків), до
яких належать дефензини (пептиди-антибіотики). Нижче наведено дані щодо
основних гуморальних факторів системи природженої резистентності.
Лізоцим (муреїназа) - фермент, який синтезується і секретується нейтро-
філами, моноцитами і макрофагами. Він міститься у всіх біологічних рідинах
організму (слині, сльозах, лікворі, сироватці крові) і обумовлює їх бактерицид-
ні властивості. Лізоцим розщеплює муреїн, що входить до складу клітинної
стінки бактерій. Це і призводить до лізису мікроорганізмів.
Комплемент є системою, що складається з власне білків комплементу,
мембранних рецепторів до комплементу, плазмових і мембранних регуляторів
активності комплементу. Власне білки комплементу - це низка глікопротеї-
нових і білкових факторів сироватки крові, яка включає 9 різних компонентів.
Комплемент функціонує як мультиферментний каскад, в якому продукт однієї
реакції є ферментом для наступної. При. цьому відбувається постійне нарощу-
вання літичного потенціалу - первинно порівняно слабкий стимул призводить
до потужного кінцевого протимікробного ефекту. Основними джерелами син-
тезу компонентів комплементу є гепатоцити і макрофаги. Крім цього, компо-
ненти комплементу виробляються в селезінці, кишківнику і кістковому мозку,
а також лімфоепітеліальними клітинами осередка запалення.
Існують два основні механізми активації комплементу: класичний та аль-
тернативний шляхи.
Класичний шлях активації комплементу позв'язаний з утворенням імун-
ного комплексу (антиген-антитіло), для чого потрібно 5-6 діб. Починається він
з першого компонента комплементу (СІ), який взаємодіє своїм Fc-рецептором з
антитілами імунного комплексу, перехресно зв'язуючи декілька їх Fc-фрагмен-
тів. Тому зручнішим для активації комплементу є IgM, що містить одразу п'ять
Fc-ділянок (див. розділ "Структура і функції системи набутого імунітету").
СІ-компонент складається з трьох субкомпонентів (q, r, s). Комплекс Clqrs
активує компонент С4, від якого відщеплюється фрагмент С4а. При цьому
фрагмент С4Ь фіксується на мембрані клітини-мішені або на антитілі, після
чого приєднує фрагмент С2а (С2Ь вивільняється і надходить до плазми крові).
Комплекс С4Ь-С2а є ферментом СЗ-конвертазою, що розщеплює СЗ-компо-
нент на фрагменти СЗа і СЗЬ. Рецептори до фрагментів СЗ містяться на бага-
тьох клітинах, тому цей компонент є найбільш активним у системі. Саме на
цьому компоненті об'єднуються класичний та альтернативний шляхи актива-
ції комплементу.
Після розщеплення третього компонента комплементу (СЗ) під дією СЗ-кон-
вертази, утворюється конвертаза 5 компоненту (C4b-C2a-C3b), яка зв'язує С5
і розщеплює його на фрагменти С5а і С5Ь. При цьому С5а надходить до плазми,
а С5Ь бере участь у подальшій активації каскаду. Наступні компоненти при ак-
тивації не розщеплюються. В подальшому послідовно активуються компоненти
С6-С9, що утворюють мембранатакуючий комплекс. При цьому С8 заглиблю-
ється в фосфоліпідний бішар цитолеми клітини-мішені і формує у ній патоло-
гічний отвір, а декілька компонентів С9 полімеризуються, утворюючи стінки
патологічної пори. Це перешкоджає закриттю сформованого отвору (рис. 2).
Оскільки внутрішньоклітинне середовище має високу осмолярність, по-
заклітинна вода інтенсивно надходить через утворені пори до цитоплазми, що
призводить до прогресуючого зростання внутрішньоклітинного тиску. При
цьому настає момент, коли відбувається критичне напруження мембрани клі-

тини і її руйнування. Зазначений механізм називається осмотичним лізисом
і справджується для клітин, що мають гнучкі зовнішні покриви (наприклад,
пухлинні або вірусінфіковані клітини). Бактерії містять ригідну клітинну стін-
ку, яка перешкоджає вираженій зміні розмірів клітини. Тому вважають, що
бактеріальні агенти поряд із осмотичним лізисом гинуть у зв'язку з втратою
есенціальних метаболітів через патологічні пори, а також внаслідок порушен-
ня фізіологічної іонної асиметрії між внутрішньо- і позаклітинним середови-
щем. Оскільки клітини-мішені чинять активний опір комплемент-опосеред-
кованому лізису (здійснюють ендоцитоз або екзоцитоз ділянок мембрани із
вбудованими порами) наведена функціональна "іммобілізація" клітини має
суттєве значення і у випадку пухлинних та вірусінфікованих клітин.
Альтернативний шлях (рис. 2.) розпочинається з СЗ-компонента, а в по-
дальшому розгортається так само, як і класичний. В ролі ініціатора виступа-
ють ліпополісахариди клітинної стінки бактерій або зимозан поверхневих
структур грибів, з якими взаємодіє СЗЬ-фрагмент третього компонента (про-
дукт спонтанного гідролізу компонента СЗ, який завжди міститься у плазмі
крові). В подальшому СЗЬ-фрагмент приєднує так званий В-фактор, який змі-
нює конформацію і стає чутливим до дії сироваткового ферменту - D-факто-
ра - і гідролізується ним з вивільненням Bb-фрагменту. Комплекс LPS-C3b-Bb
нестійкий, а тому потребує стабілізації за рахунок приєднання пропердину
(фактору Р). Комплекс Р-СЗЬ-Bb є конвертазою СЗ-компоненту альтернатив-
ного шляху активації комплементу. Фактори В, D і пропердин - належать до
так званої пропердинової системи, яка необхідна для реалізації альтернатив-
ного шляху. Цитолітична активність при цьому визначається властивостями
оболонки мікроорганізму. Оскільки в даному випадку не потрібне формування
імунних комплексів, альтернативний шлях реалізується одразу ж після надхо-
дження антигену.
Останнім часом окремо виділяють так званий лектиновий шлях активації
комплементу. Здійснюється він за рахунок лектинів - білків, що здатні зв'язу-
вати вуглеводи клітинних стінок бактерій. Класичним лектином є манозозв'я-
зуючий протеїн (див. нижче).
Поряд з численними компонентами комплементу в плазмі крові циркулює
низка білків з антагоністичними властивостями, які обмежують активацію
системи комплементу під час знешкодження патогену. Один з найважливіших
з них - так званий інгібітор першого компоненту (С1-інгібітор), дефіцит якого
обумовлює підвищений ризик розвитку ангіоневротичного набряку. Так зва-
ний фактор Н інактивує СЗЬ, опосередковуючи подальше його розщеплення
на фрагменти СЗс і C3d, а фактор І руйнує СЗЬ і С4Ь.
Отже, одразу два фактори нейтралізують СЗЬ. Це необхідно для коректної
роботи альтернативного шляху. Справа в тому, що надлишок цього фрагменту
здатен викликати необгрунтовану гіперактивацію комплементу, яка супрово-
джується самопошкодженням. Уже зазначалося, що ініціація каскаду відбува-
ється за рахунок СЗЬ, що утворюється при спонтанному гідролізі компоненту
СЗ. Спонтанний гідроліз завжди має обмежений характер, що унеможливлює
гіперактивацію. Проте під впливом СЗ-конвертази СЗЬ утворюється у кількос-
ті, достатній для ініціації нового каскаду, при розгортанні якого вивільниться
додаткова порція СЗЬ. За рахунок цього позитивного зворотного зв'язку комп-
лемент нарощує літичний потенціал в умовах незмінної кількості патогену.
Проте у разі недостатнього контролю цілком можлива необгрунтована гіпе-
рактивація альтернативного шляху і пошкодження власних тканин. До того ж
потенціювати альтернативний механізм може і СЗЬ, вивільнений при реаліза-
ції класичного шляху у разі його паралельного розгортання. Тому адекватна
інактивація СЗЬ необхідна для коректної роботи всієї системи.
Розрізняють 4 типи рецепторів до компонентів комплементу (англ. - comp-
lement receptor, CR,, CR,,, CRm, CR,V). Рецептор першого типу (CR,) міститься
на поверхні антигенпрезентуючих клітин та еритроцитів. Він опосередковує
захоплення патогену, до якого приєднані опсоніни СЗЬ або С4Ь. Зв'язування
еритроцитами імунних комплексів сприяє їх транспорту до печінки і селезін-
ки, де перебувають макрофаги. Рецептор другого типу (CR,,) міститься на
В-лімфоцитах і фолікулярних дендритних клітинах. Він бере участь у фікса-
ції імунних комплексів наведеними клітинами в зародкових центрах фолікулів
лімфатичних вузлів, обумовлюючи подальший соматичний гіпермутагенез
імуноглобулінових рецепторів В-лімфоцитів і формування В-клітин пам'яті
(див. нижче). CR,,, і CRIV за своєю природою належать до р2-інтегринів (адге-
зійних молекул) і є специфічними до фрагментів іСЗЬ (інактивованого) та C3d.
Містяться вони здебільшого на фагоцитах і виконують подвійну функцію.
По-перше, ці рецептори сприяють міграції фагоцитів до осередку запалення,
оскільки здатні взаємодіяти з адгезійними мембранними молекулами ІСАМ-1
і ІСАМ-2, експресія яких є одним з орієнтирів для спрямованого переміщення
клітин. По-друге, фагоцити після прибуття до осередку саме завдяки CR,,, CR,V
розпізнають компоненти комплементу, сприяючи фагоцитозу міченого опсоні-
нами патогену.
Оскільки комплемент здійснює достатньо неспецифічне розпізнавання,
а мембранні структури власних клітин зазнають динамічних змін, існує по-
тенційна загроза комплемент-опосередкованої аутоагресії. Для її уникнення
в мембрани власних клітин вбудовано захисні білки, що інактивують каскад
комплементу. Йдеться про фактор, який прискорює розпад (англ. - decay-
accelerating factor, DAF), що міститься на формених елементах крові, епітелі-
оцитах і клітинах ендотелію. Він посилює катаболізм СЗ- і С5-конвертаз. До
мембранних захисних молекул також належить мембранний кофакторний
протеїн (англ. membrane cofactor protein, МСР), який є кофактором у протеолі-
зі СЗЬ і С4Ь за допомогою І-фактору.
При активації каскаду комплементу до плазми вивільняється низка фраг-
ментів окремих компонентів (С4а, С2Ь, СЗа, С5а, а також СЗЬ і С4Ь), які вико-
нують низку важливих функцій. Таким чином, комплемент є дуже економною
системою, оскільки навіть побічні продукти реакції наділені вираженою біоло-
гічною активністю. Вони сприяють розвитку запалення у місці знешкодження
патогену. Так, СЗа, С4а і С5а (анафілотоксини) негайно викликають дегра-
нуляцію опасистих клітин і вивільнення гістаміну, з чим пов'язаний розвиток
гіперемії, локальної гіпертермії і набряку тканини в місці перебування патоге-
ну. С5а (хемоатрактант) сприяє надходженню нейтрофілів до вогнища і роз-
виткові його клітинної інфільтрації. Фрагменти СЗЬ і С4Ь виконують функцію
Дата добавления: 2016-08-07; просмотров: 646;
