в історичному аспекті 4 страница
фрагментів (пептидів) Т-хелперам, тобто забезпечують підтримання імун-
ної відповіді.
3. Здійснюють літичну функцію, яка полягає у здатності макрофагів пошкоджу-
вати різні клітини-мішені у клітинно-опосередкованих реакціях імунітету
(реакції антитілозалежної клітинно-опосередкованої цитотоксичності).
4. Виконують секреторну функцію, яка полягає у виробленні ферментів (ней-
тральних протеаз і кислих гідролаз), компонентів комплементу, інгібіторів
ферментів, компонентів міжклітинного матриксу, біологічно активних ліпі-
дів (простагландинів, лейкотрієнів), ендогенних пірогенів, а також доімун-
них цитокінів - ІЛ-ір, ІЛ-6 і ФНП-а .
5. Змінюють метаболізм організму при запаленні.
6. Беруть участь у асептичному запаленні і знешкодженні сторонніх частинок.
Нейтрофільним гранулоцитам притаманні функції хемотаксису, фа-
гоцитозу і секреції. На відміну від інших фагоцитів (макрофагів), нейтрофіли
не виконують антигенпрезентуючої функції, у зв'язку з чим вони використо-
вуються тільки як клітини-ефектори. Саме нейтрофіли першими надходять до
осередку запалення. Це пов'язано з підвищеною чутливістю до хемоатрактан-
тів - речовин, що опосередковують цілеспрямоване надходження клітин до вог-
нища запалення. Функцію хемоатрактантів нейтрофілів виконують фрагменти
комплементу С5а і Ва, лейкотрієни (особливо лейкотрієн В4), а також спеціалі-
зовані цитокіни - так звані хемокіни (а- і р-групи). Крім того, ці клітини по-
стійно перебувають у пристінковому шарі плазми, будучи готовими в будь-який
момент залишити судину і попрямувати до осередку перебування патогену.
Нейтрофіли здатні до фагоцитозу, але виконують його менш ефективно,
ніж макрофаги. Тому ці клітини часто називають мікрофагами. Більш типо-
вою реакцією нейтрофілу на патоген є вивільнення назовні цитоплазматичних
гранул, де зосереджені агресивні молекули клітини (реакція дегрануляції).
Нейтрофіли містять 2 основних типи гранул (первинні і вторинні). В пер-
винних гранулах містяться кислі гід рол ази (фукозидаза, нуклеотидаза, галактозидаза, манозидаза та інші), нейтральні протеїнази (катепсин G, еластаза,
колагеназа), а також катіонні білки, мієлопероксидаза, лізоцим і мукополі-
сахариди. У вторинних гранулах немає кислих гідролаз, тут містяться тільки
активні за нейтральних і лужних значень рН агенти (лужна фосфатаза, лак-
тоферин, лізоцим і білок, що зв'язує вітамін В]2). Крім того, нейтрофіли є
активними продуцентами вільних радикалів, які забезпечують максимальний
пошкоджуючий вплив. Тактика нейтрофілу полягає у першочерговому вивіль-
ненні у навколишню тканинну рідину вільних радикалів та вмісту вторинних
гранул, ферменти яких активні саме на початкових етапах запалення, поки в
осередку не розвинувся виражений ацидоз. Пізніше нейтрофіл вивільняє пер-
винні гранули, кислі гідролази яких активно функціонують при низьких зна-
ченнях рН. Природно, що в результаті описаних процесів руйнується не тільки
патоген, а і зазнають певного пошкодження і власні тканини, що викликає фор-
мування при запаленні тканинного детриту. При великому мікробному наван-
таженні рештки зруйнованих патогенів і тканинний детрит разом із загиблими
нейтрофілами утворюють субстрат гнійного ексудату. Справа в тому, що при
фагоцитозі для утворення фагосом використовується матеріал цитолеми, тому
площа її постійно зменшується. Нейтрофіли (на відміну від макрофагів) не
мають надійної системи регенерації мембрани, а тому гинуть при переванта-
женні патогеном. Крім того, при вираженому мікробному обсіменінні нейтро-
філи змушені здійснювати надлишкову продукцію вільних радикалів, яких не
в змозі знешкодити їх антиоксидантні системи, що призводить до руйнування
самих клітин-продуцентів. Таким чином, за рахунок інтенсивної секреції і фа-
гоцитозу нейтрофіли здійснюють (іноді ціною власного існування) ефектив-
ний протимікробний захист.
Подібні фактори агресії здатні синтезувати і макрофаги, проте останні на-
копичують їх переважно у фаголізосомах і менш інтенсивно секретують назо-
вні. Макрофаги не містять гранул, а тому змушені використовувати секреторні
везикули, що відділяються від комплексу Гольджі. Давно помічено, що у разі
макрофагальної інфільтрації зазвичай не відбувається формування гнійно-
го ексудату. Цей феномен пояснюється більш поміркованою секрецією ними
вільних радикалів і наявністю ефективної регенерації цитолеми при фагоцито-
зі, що обумовлює виживання клітини і необхідне для забезпечення подальшої
антигенної презентації.
Дендритні КЛІТИНИ (рис. 4). Ключовим компонентом природжених ме-
ханізмів резистентності є дендритна клітина. Здатність дендритних клітин до
захоплення і знешкодження патогену значно нижча у порівнянні з їх антигенп-
резентуючою активністю, оскільки процеси антигенної презентації здійсню-
ються цими клітинами на декілька порядків ефективніше, ніж іншими анти-
генпрезентуючими клітинами. Тому дендритні клітини призначені не стільки
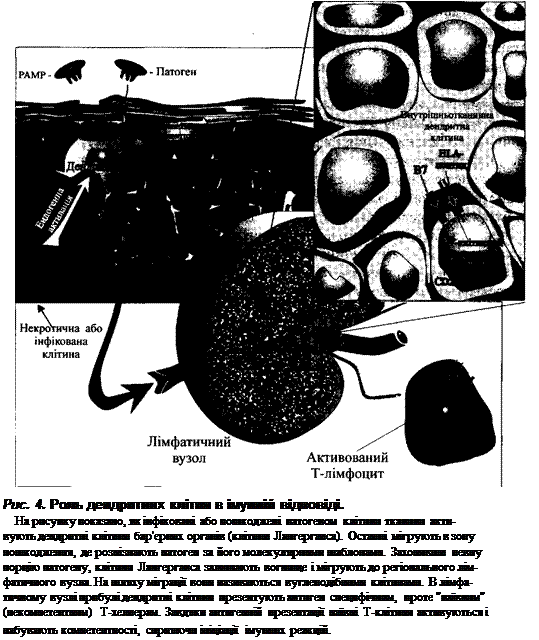
для безпосередньої елімінації патогену, скільки для ініціації та регуляції Т- та
В-клітинної імунної відповіді, спрямованої проти цього патогену. Для здій-
снення такої функції дендритні клітини мають унікальну здатність активувати
так звані "наївні" Т-лімфоцити (такі, що не зустрічалися з антигеном). Окрім
того, слід звернути увагу на органну приуроченість дендритних клітин. Так,
дендритні клітини шкіри (клітини Лангерганса) постійно захоплюють по-
заклітинні антигени. Коли рецептори шаблонного розпізнавання дендритних
клітин взаємодіють з патогензв'язаними молекулярними шаблонами патоге-
ну, ці клітини активуються і поводять себе як антигенпрезентуючі. Ендогенні
сигнали про небезпеку (синтез інтерферону-сс вірусінфікованими клітинами
або підвищення рівня білків теплового шоку в результаті некротичної загибелі
клітин) також активують дендритні клітини. Активовані клітини мігрують до
найближчого дренуючого лімфатичного вузла, де вони презентують антиген
Т-лімфоцитам. При цьому антиген попередньо розщеплюється внутрішньо-
клітинно до коротких пептидів.
На мембрані дендритних клітин містяться наступні рецептори шаблонного
розпізнавання: рецептори до ліпополісахаридів, рецептор до манози, компонен-
ти родини молекул, названі toll-like. Молекулярними шаблонами, що здатні вза-
ємодіяти з відповідними рецепторами дендритних клітин, є маноза клітинних
стінок мікробів, поверхневі ліпополісахариди грамнегативних бактерій, а також
тейхоєві кислоти, які входять до складу поверхневих структур грампозитивних
бактерій. Активація ґо//-//А:е-рецепторів примушує дендритні клітини збільшу-
вати експресію В7-костимуляційних молекул (відомих як CD80 і CD86), які є
додатковими, але вкрай необхідними сигналами, що визначають активацію і
виживання Т-лімфоцит при взаємодії його з антигенпрезентуючою клітиною.
При активації дендритні клітини шкіри (або слизових оболонок) мігрують
по лімфатичних судинах у напрямку лімфатичних вузлів і селезінки. Протягом
цього періоду їх називають вуалеподібними клітинами. Вуалеподібні клі-
тини є переносниками антигену із шкіри і слизових до лімфоїдних органів.
Дендритні клітини селезінки (інтердигітальні клітини) перебувають у Т-за-
лежній зоні органу (періартеріолярних муфтах). Вони розміщують свої від-
ростки між Т-клітинами і здійснюють презентацію антигену, ініціюючи імун-
ну відповідь. У фолікулах лімфатичних вузлів і селезінки містяться дендритні
фолікулярні клітини, які зв'язують на своїй поверхні антигени або імунні
комплекси (антиген-антитіло-комплемент), не фагоцитуючи їх. Це явище іні-
ціює формування зародкових центрів, які є окремими ділянками в межах фо-
лікулів селезінки та лімфатичних вузлів, де розгортаються активні В-клітинні
реакції. В зародкових центрах відбувається проліферація активованих В2-лім-
фоцитів, яка супроводжується соматичною гіпермутацісю їх рецепторів анти-
генного розпізнавання. В результаті соматичної гіпермутації формується низ-
ка В-клітин з певними відмінностями у структурі антигензв'язуючого сайту,
специфічного до даного антигену. Шляхом взаємодії з фіксованим на поверхні
фолікулярної дендритної клітини антигеном відбираються В-лімфоцити з най-
більш комплементарними імуноглобуліновими рецепторами до антигенних
детермінант збудника. Саме таким В-лімфоцитам і буде забезпечено подальшу
клональну експансію. Окрім цього, вважають, що фолікулярні дендритні клі-
тини, тривало зберігаючи антиген, беруть участь у формуванні імунної пам'яті
(див. "Імунна пам'ять").
Так звані тимічні дендритні клітини здатні презентувати власні антигени
дозріваючим Т-лімфоцитам тимусу, беручи участь у формуванні імунної толе-
рантності шляхом негативної селекції (див. "Імунна толерантність").
Слід зазначити, що активовані дендритні клітини можуть впливати на ви-
значення переважного шляху розгортання імунної реакції за рахунок синтезу
цитокінів. Вважають, що при синтезі інтерлейкіну 12 наступні імунні реакції
будуть розгортатися за клітинним типом, а при переважній продукції інтерлей-
кіну 4 або ІЛ-ір будуть активовані гуморальні реакції імунітету.
Функції дендритних клітин:
1. Здійснення презентації імуногенних пептидів і забезпечення ініціації імун-
ної відповіді.
2. Участь у визначенні спрямування імунної відповіді (за клітинним типом / за
гуморальним типом).
3. Підтримання функціонального зв'язку між місцем перебування патогену та
імунними органами.
4. Обслуговування В-клітинних реакцій і забезпечення корекції специфіки
імуноглобулінових рецепторів.
5. Участь у підтриманні імунної толерантності (як центральної, так і перифе-
рійної).
6. Участь у формуванні імунної пам'яті.
7. Забезпечення безпосереднього знищення патогену.
Природні кілери (ПК). Це великі гранулярні лімфоцити - низькоди-
ференційовані нащадки стовбурової клітини крові. Розрізняють тканинні і
циркулюючі ПК. Тканинні ПК містяться в печінці та плаценті, забезпечуючи
підтримання імунної толерантності до харчових антигенів та антигенів плоду
відповідно. Для цього такі клітини зв'язуються з активованими лімфоцита-
ми й ініціюють каскад апоптозу в них, тобто здійснюють кілінговий ефект.
Циркулюючі ПК беруть участь у забезпеченні захисту від змінених власних
клітин (старих, мутантних, інфікованих, пухлинних).
Реакція, в якій бере участь природний кілер, називається спонтанною клі-
тинно-опосередкованою цитотоксичністю (СКОЦ), оскільки для неї не по-
трібні антитіла і комплемент. Проте ці клітини містять і Fc-рецептори, а тому
можуть залучатися до реакцій антитілозалежної клітинно-опосередкованої
цитотоксичності (рис. 5).
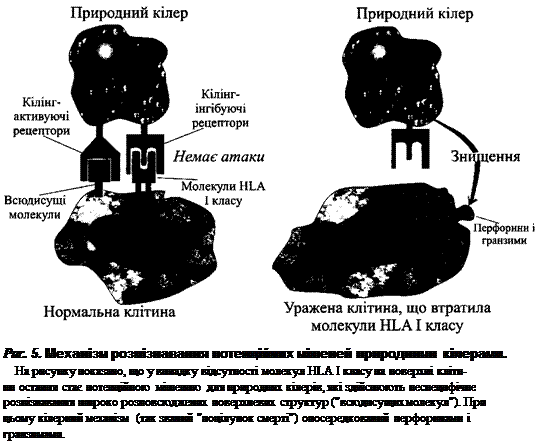
Механізм СКОЦ полягає у наступному. За допомогою кілінгактивуючого
рецептора природні кілери взаємодіють з олігоцукрами гангліозидів і гліко-
заміногліканів поверхневих структур клітин-мішеней. Оскільки такі молеку-
ли є "всюдисущими", природні кілери потенційно можуть проявляти агресію
до багатьох власних клітин. Цілком зрозуміло, що це недопустимо. Активації
природного кілера перешкоджає кілінгінгібуючий рецептор, що розпізнає
молекули HLA І класу (тільки ті різновиди, що притаманні певному організ-
му). Тому клітини-мішені відбираються за експресією специфічних молекул
HLA І класу - при відсутності їх експресії або "чужій" структурі молекул гіс-
тосумісності запускається кілінговий ефект.
Наведені дані свідчать про те, що ПК активуються при порушенні балан-
су між тригерними й інгібуючими рецепторами. Перші реагують не тільки на
мікробні продукти, але й на структури активно проліферуючих власних клі-
тин, другі - на HLA-антигени (мітки "свого"). Таке поєднання неспецифіч-
них тригерних і специфічних інгібуючих рецепторів дозволяє ПК ефективно
реагувати на широке коло мішеней - від чужорідних мікробів, ксеногенних і
алогенних клітин до власних патологічно змінених або навіть просто надмірно
активних клітин.
На мембрані природних кілерів є рецептори до інтерферону-у, ІЛ-2 та ІЛ-
12. Також тут містяться диференційні антигени CD16 і CD56, за якими лабора-
торно виявляють ці клітини.
Опасисті КЛІТИНИ (тканинні базофіли). Ці клітини є ефекторною лан-
кою атопічних реакцій, однак їх залучення тією чи іншою мірою відбувається
за умови будь-якої імунної реакції. Опасисті клітини отримали свою назву у
зв'язку з наявністю великої кількості гранул, які щільно виповнюють їх цито-
плазму. В цих гранулах містяться гістамін (біогенний амін, утворений шляхом
декарбоксилювання амінокислоти гістидину), гепарин (протеоглікан, який за
рахунок іонних взаємодій утримує молекули біогенного аміну), деякі фермен-
ти (триптази, хімази, карбоксипептидаза А) і хемотаксичні фактори. Гепарин
поряд з антикоагуляційною чинить виразну імуномодулюючу дію. Основні
біологічні ефекти гістаміну полягають у підвищенні проникності стінок судин
та вазодилатації в осередку його вивільнення. Судинорозширювальний ефект
пов'язаний з активацією синтезу ендотеліальними клітинами простацикліну
(ПгІ2) та оксиду азоту (N0). Підвищення проникності судин виникає внаслі-
док контрактильних змін цитоскелету ендотеліоцитів і збільшення міжклітин-
них проміжків. Це сприяє плазморагії і набряку тканини, а також полегшує діа-
педез фагоцитів і їх надходження до осередку запалення. Синергічний ефект
чинить гістамін-опосередковане посилення експресії ендотеліальних адгезій-
них молекул.
Поверхня опасистої клітини густо вкрита високоафінними рецепторами до
Fc-фрагментів IgE. У разі первинного надходження певного антигену до орга-
нізму відбувається синтез специфічних IgE (сенсибілізація до антигену), які
зв'язують відповідні рецептори опасистих клітин константними ділянками,
а антигензв'язуючі сайти орієнтуються назовні. Зв'язані антитіла починають
виконувати функцію рецепторів антигенного розпізнавання опасистих клітин.
Отже, ці клітини не синтезують власних антигенрозпізнавальних рецепторів,
а "наймають" секреторні рецептори В-лімфоцитів. При повторному надхо-
дженні антигену відбувається його зв'язування з IgE, що ініціює дегрануляцію
опасистих клітин і вивільнення (лібералізацію) гістаміну й інших біологічно
активних молекул, які справляють описаний вище ефект.
Базофільні гранулоцити крові також містять гранули з гістаміном і
рецептори до Fc-фрагментів IgE. Відмінність між цими типами клітин полягає
в їх локалізації і термінах залучення до реакцій проти патогену. Так, опасисті
клітини містяться в пухкій сполучній тканині різних органів, а базофіли цир-
кулюють у плазмі крові. Тому базофільні гранулоцити надходять до тканин
тільки у разі формування в них осередку запалення, а значить, виконують свою
функцію з певним запізненням у порівнянні з опасистими клітинами. У той же
час, при первинному проникненні патогену до системної циркуляції першими
вступають у дію базофіли крові.
Функції базофільних гранулоцитів крові:
1. Продукція, запасання і вивільнення гістаміну.
2. Зберігання значної кількості високоафінних рецепторів до IgE, що дозволяє
їм залучатися до імунної відповіді.
3. Вивільнення активатора плазміногену, що бере участь в регуляції кількості
фібрину.
Еозинофільні гранулоцити містять гранули, де перебуває низка біо-
логічно активних речовин, здатних до фагоцитозу і хемотаксису. Агенти, що
містяться в еозинофілах, виконують різні функції, в тому числі - протиалер-
гійну, сприяючи розщепленню біологічно активних речовин, які виділяються у
ранній фазі атопічних реакцій. Так, гістаміназа здійснює інактивацію гістамі-
ну, арилсульфатаза В розщеплює лейкотрієни, а фосфоліпаза D - тромбоци-
тактивуючий фактор. Проте саме еозинофіли опосередковують прояви пізньої
фази, тому їх роль у алергії неоднозначна.
Також еозинофіли відіграють важливу роль у захисті від гельмінтів і най-
простіших, беручи участь у реакціях антитілозалежної клітинно-опосеред-
кованої цитотоксичності (АЗКОЦ). Антитіла при цьому відносяться до класу
IgE та IgA. Механізм АЗКОЦ полягає у наступному. На мембрані еозинофіла є
рецептори до Fc-фрагменту IgE. Коли Fab-фрагмент IgE приєднується до анти-
генної детермінанти гельмінта, до Fc-фрагмента цього антитіла приєднується
еозинофіл, який і здійснює цитотоксичний ефект.
Функції еозинофільних гранулоцитів:
1. Знищення гельмінтів, токсоплазм, хламідій, лямблій, лістерій (АЗКОЦ).
2. Синтез фібринолізину.
3. Виділення речовин, які стимулюють синтез ДНК у фібробластах.
4. Продукція факторів, які пригнічують дегрануляцію базофілів крові і опа-
систих клітин.
5. Захоплення гранул, які містять гістамін, сорбція останнього на своїй по-
верхні і наступне його руйнування за рахунок гістамінази.
6. Інактивація прозапальних лейкотрієнів і тромбоцитактивуючого фактора.
7. Потенціювання реакцій пізньої фази атопії, що поряд з інактиваційним
впливом на БАР ранньої фази забезпечує регуляторну функцію еозинофілів
при атопії.
Тромбоцити мають виражені цитотоксичні властивості. Встановлено,
що тромбоцити містять Fc-рецептори і рецептори до Clq компонента компле-
менту, у зв'язку з чим їх активація можлива під впливом імунних комплексів,
які містять, як відомо, і Fc-фрагменти антитіл, і Clq компонент комплементу.
При активації тромбоцити вивільняють біологічно активні речовини (серото-
нін, адреналін, ТрА2), а також продукують вільні радикали, катепсини і кислі
гідролази. Перші субстанції сприяють розвитку реакції запалення, а другі - чи-
нять безпосередній пошкоджуючий ефект на патоген. Чітко доведена цитоток-
сичність тромбоцитів при генералізованих протозойних інфекціях і гельмінто-
зах із внутрішньо судинним перебуванням патогену (наприклад, шистосомоз).
Еритроцити. Досить цікава роль еритроцитів при інфекції. Відомо, що
мембрани еритроцитів надзвичайно біологічно активні й адсорбують на своїй
поверхні велику кількість циркулюючих у крові антигенів. Завдяки наявнос-
ті рецепторів до Fc-фрагментів антитіл, Clq і СЗЬ компонентів комплементу
еритроцити здатні здійснювати імунну адгезію часток, навантажених зазна-
ченими структурами. При цьому вони виконують дезінтоксикаційну функцію,
а також доставляють фіксовані патогени для макрофагів селезінки і печінки.
Еритроцити не здатні знищувати адсорбовані на своїй поверхні патогени,
оскільки позбавлені факторів агресії. Зазвичай вони самі стають мішенню для
атаки інших компонентів природженої резистентності, зокрема, тромбоцитів,
що можуть утворювати тісні контакти з еритроцитами.
Відомо, що в умовах анемії інфекції характеризуються тяжчим перебігом.
Цей факт пояснюється не тільки гіпоксією, але і недостатньою функцією ери-
троцитів як компонентів природженого імунітету організму.
Резюме. Як бачимо, компоненти природженої резистентності надзвичай-
но різнорідні за структурою, місцем синтезу і функціональною активністю.
Єдина їх спільна риса - участь у боротьбі з патогеном на підставі неспецифіч-
ного розпізнавання. Останнім часом все більшу увагу приділяють саме фак-
торам неспецифічної резистентності і схиляються до думки, що їх значення
принаймні не менше, аніж імунних факторів. При цьому керуються наступни-
ми положеннями. Мікробне вторгнення в організм відбувається щосекунди,
а розвиток клінічно маніфестних форм інфекції, при яких активуються влас-
не імунні фактори, - порівняно нечаста подія. Крім того, без належної участі
чинників природженого захисту ініціація імунної відповіді стає неможливою.
Більше того, завдяки останнім даним встановлено, що виконання таких клю-
чових і, здавалось би, специфічних імунних функцій, як підтримання імунної
толерантності і формування імунної пам'яті, відбувається в якнайтіснішому
взаємозв'язку з факторами природженої резистентності і не може бути корект-
но реалізоване без їх участі.
§5. Роль факторів набутого імунітету
у захисті від патогенів
1. Структура і функції системи набутого імунітету
Основна функція імунної системи - імунний нагляд, що полягає у захисті
організму від ендо- та екзогенних речовин, які мають ознаки чужорідної генетич-
ної інформації. Розрізняють центральні та периферійні органи імунної системи.
Центральними органами є тимус і червоний кістковий мозок, а периферійни-
ми - селезінка, лімфатичні вузли, лімфоглоткове кільце Пирогова-Вальдейєра,
лімфоїдна тканина кишківника (пейєрові бляшки і солітарні лімфатичні фоліку-
ли, апендикс). У центральних органах клітини імунної системи зароджуються
і розвиваються, а в периферійних - функціонують, тобто специфічно розпізна-
ють різноманітні антигени. Отже, в центральних органах відбувається антиген-
незалежний етап розвитку лімфоцитів, а в периферійних - антигензалежний.
Таким чином, імунна система - це сукупність лімфоїдних органів, тка-
нин та клітин, що забезпечують біохімічну, структурну і функціональну
індивідуальність організму шляхом елімінації з нього носіїв чужорідної
генетичної інформації (П.Ф. Литвицький, 1992).
Імунна система не може перебувати у стані спокою, оскільки в організмі
постійно відмирають старі клітини, з'являються клітини з дефектами, крізь за-
хисні покриви безперервно надходять антигени. Доведено, що постійний кон-
такт людини з оточуючими мікроорганізмами забезпечує швидке реагування
на антигени хвороботворних агентів. Навпаки, тривале перебування у ізольо-
ваному просторі (корабель, підводний човен, космічний апарат) призводить до
різкого зниження захисних сил організму.
1.1. Поняття про імунокомпетентні клітини
Носіями імунної функції є імунокомпетентні клітини (лімфоцити).
Залежно від місця дозрівання розрізняють тимус-залежні (Т-лімфоцити) і тимус-
незалежні (В-лімфоцити) клітини. Літера "В" у назві останніх походить від
скорочення назви імунного органу птахів (сумки Фабриціуса), де відбувають-
ся активні В-клітинні реакції. Принциповою особливістю імунокомпетентних
клітин є наявність на їх поверхні спеціальних рецепторів для розпізнавання
антигенів. Так, Т-лімфоцити містять Т-клітинні антигенрозпізнавальні рецеп-
тори (ТАГРР), а В-лімфоцити - імуноглобулінові рецептори (мономери IgM).
За хімічною структурою такі молекули відносяться до суперродини імуногло-
булінів. Так, на поверхні кожного В-лімфоцита міститься до 100 000 імуноглобулінових молекул однієї специфічності. Від кількості молекул, які зв'яжуться
з антигеном, залежить інтенсивність активаційного сигналу, який надійде до
цитоплазми В-лімфоцита. Через 5-10 днів із однієї активованої активно про-
ліферуючої В-клітини утворюється до 1 мільйона клітин з імуноглобулінови-
ми рецепторами ідентичної специфічності. Так утворюється клон (популяція
ідентичних клітин) специфічних до даного антигену В-лімфоцитів. Паралельно
формується клон антигенспецифічних Т-лімфоцитів. Отже, за природою імун-
на відповідь є специфічною і клональною.
1.2. Етапи дозрівання імунокомпетентних клітин
Стовбурова гемопоетична клітина червоного кісткового мозку є попере-
дницею всіх клітин крові, в тому числі - клітин імунної системи. Під впливом
цитокінів вона здатна або мігрувати до тимусу, де перетворюється на Т-лімфо-
цит, або залишатися у кістковому мозку, де трансформується на В-лімфоцит.
Таким чином, напрямок диференціювання стовбурової клітини визначається її
специфічним мікрооточенням.
І етап дозрівання імунокомпетентних клітин називається етапом ранніх
попередників. На стовбурових клітинах з'являються рецептори, які визнача-
ють не тільки характер міграції клітини, але і процеси її проліферації. Якщо
на стовбуровій клітині з'являється L-ланцюг (сурогатний легкий ланцюг іму-
ноглобуліну), клітина диференціюється у В-лімфоцит, а якщо глікопротеїн з
молекулярною масою 33 кілодальтон (ГП 33 кД), вона стає раннім попе-
редником Т-лімфоцита. При появі таких поверхневих рецепторів запускаєть-
ся процес інтенсивної проліферації попередників лімфоцитів, у зв'язку з чим
протягом тижня їх кількість збільшується більше ніж у 100 разів.
II етап дозрівання імунокомпетентних клітин називається етапом зрілих
попередників. На цій стадії на попередниках В-лімфоцитів з'являється IgM
у формі мономеру, а на попередниках Т-лімфоцитів - Т-клітинний антиген-
розпізнавальний рецептор (ТАГРР). На етапі зрілих попередників формуються
лімфоцити, кожен з яких містить рецептор однієї специфічності (до одного
конкретного антигену). Важливо відмітити, що специфічні Т- і В-лімфоцити
утворюються в організмі апріорно, ще до зустрічі зі "своїм" антигеном.
НІ етап - селекція (відбір) Т- і В-лімфоцитів, які не здатні реагувати із
власними антигенами. На цьому етапі відбувається усунення від можливої
імунної відповіді аутореактивних лімфоцитів, тобто формування імунної то-
лерантності (див. розділ "Імунна толерантність"). Процес формування імун-
ної толерантності складається з двох етапів:
1) формування імунної толерантності в центральних органах імунної сис-
теми шляхом делеції - руйнування аутореактивних Т- і В-лімфоцитів за меха-
нізмом апоптозу (запрограмованої загибелі клітини).
2) формування імунної толерантності в периферійних органах шляхом
індукції анергії - переведення аутореактивних Т- і В-лімфоцитів у довічний
стан спокою (функціональної бездіяльності).
IV етап дозрівання імунокомпетентних клітин полягає у формуванні зрі-
лих Т- і В-лімфоцитів, що перебувають у стані відносного спокою, однак здат-
ні до імунної відповіді на специфічний антиген.
1.3. Органи імунної системи
Центральні імунні органи
Червоний кістковий мозок - центральний орган імунної системи, що
виконує не тільки лімфопоетичну, але й гемопоетичну функцію в цілому.
Червоний кістковий мозок містить стовбурові клітини крові (джерело утво-
рення імунокомпетентних клітин) і клітини лімфоїдного ряду на початкових
стадіях свого розвитку, оточені складною ретикулярною системою епітеліоїд-
них клітин, яка складає специфічне мікрооточення дозріваючим імуноцитам.
Саме тут розпочинають своє дозрівання як Т-, так і В-лімфоцити. В подальшо-
му Т-лімфоцити залишають червоний кістковий мозок і мігрують до тимуса,
де відбуваються завершальні етапи антигеннезалежної диференціації цих клі-
тин. Антигеннезалежна диференціація В-лімфоцитів повністю відбувається в
червоному кістковому мозку.
Тимус - центральний орган імунної системи, де відбуваються завершальні
етапи антигеннезалежної диференціації Т-лімфоцитів. Морфологічно в тимусі
виділяють медулярну й кіркову зони. З червоного кісткового мозку незрілі
Т-лімфоцити прибувають до кіркового шару тимуса, а по мірі дозрівання пере-
міщуються до мозкового. З мозкового шару зрілі Т-клітини залишають тимус
і надходять до лімфатичних вузлів різної локалізації. Належні умови для ан-
Дата добавления: 2016-08-07; просмотров: 536;
