РОЗРАХУНКОВА РОБОТА №2.
ОЦІНКА СТІЙКОСТІ КАРБОНАТНО-
КАЛЬЦІЄВОЇ СИСТЕМИ
Теоретичний вступ
Якщо в природній воді знаходяться вільна карбонатна кислота, йони Са2+ і НСО3-, а в твердій фазі – СаСО3, то між ними існує рівновага
СаСО3 + Н2О + СО2 L Са(НСО3)2 (1)
Переважання прямої реакції свідчить про розчинення вапняків під дією СО2, зворотної – про накопичення карбонатних порід за рахунок розкладання кальцій гідрогенкарбонату. Розчинення твердої фази СаСО3 у воді відбувається в межах її розчинності
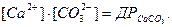 (2)
(2)
За наявності у воді надлишку СО2 слаборозчинний СаСО3 переходить в більш розчинний кальцій гідрогенкарбонат за рівнянням (1) доки не настане рівновага. Кількісна залежність у рівновазі визначається розчинністю твердої фази СаСО3 (2) і дисоціацією каобнатної кислоти за першим і другим ступенем:
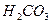 L
L 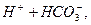
звідки 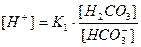 (3)
(3)
і 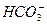 L
L 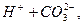
звідки 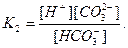 (4)
(4)
З рівняння (2): 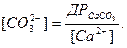
Підставимо значення [H+] і [CO32-] в рівняння (4), тоді одержимо:
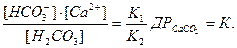
 (5)
(5)
Після введення коефіцієнтів активності йонів і враховуючи, що в природних водах з малою мінералізацією [H2CO3] G [CO2] і 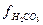 =1, стійкість карбонатно-кальцієвої системи оцінюється такими рівняннями:
=1, стійкість карбонатно-кальцієвої системи оцінюється такими рівняннями:
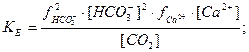 (6)
(6)
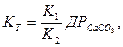 (7)
(7)
де  і
і 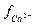 коефіцієнти активності відповідно гідрогенкарбонат-йонів і йонів Кальцію; [HCO3-], [Ca2+] і [CO2] – рівноважні молярні концентрації відповідних йонів і вільного карбон(IV) диоксиду у воді;
коефіцієнти активності відповідно гідрогенкарбонат-йонів і йонів Кальцію; [HCO3-], [Ca2+] і [CO2] – рівноважні молярні концентрації відповідних йонів і вільного карбон(IV) диоксиду у воді; 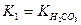 і
і 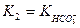 , відповідно перша і друга константи дисоціації карбонатної кислоти,
, відповідно перша і друга константи дисоціації карбонатної кислоти, 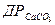 - добуток розчинності СаСО3. Рівняння (6) і (7) дозволяють зробити такі висновки:
- добуток розчинності СаСО3. Рівняння (6) і (7) дозволяють зробити такі висновки:
- якщо при підстановці в рівняння аналітичних концентрацій йонів Кальцію, гідрогенкарбонат-йонів і вільної карбонатної кислоти 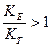 (КЕ – експериментальний коефіцієнт, знайдений при підстановці аналітичних даних, КТ – теоретичний коефіцієнт, який є відомою величиною для даної рівноважної системи), то розчин містить надлишок Са(НСО3)2;
(КЕ – експериментальний коефіцієнт, знайдений при підстановці аналітичних даних, КТ – теоретичний коефіцієнт, який є відомою величиною для даної рівноважної системи), то розчин містить надлишок Са(НСО3)2;
- якщо 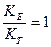 , то карбонатно-кальцієва система знаходиться в рівновазі;
, то карбонатно-кальцієва система знаходиться в рівновазі;
- якщо 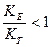 , то вода містить надлишок СО2.
, то вода містить надлишок СО2.
Наближено можна вважати, що в розбавлених розчинах коефіцієнт активності йона залежить від заряду йона і йонної сили розчину μ, яка дорівнює півсумі добутку молярної концентрації (СМ) кожного йона на квадрат його заряду (z):
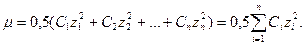 (8)
(8)
Якщо μ<0,02, то коефіцієнт активності йона в розбавленому розчині можна обчислювати за формулою
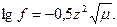 (9)
(9)
Якщо йонна сила розчину 0,02 < μ < 0,1, то коефіцієнт активності розраховують за формулою Дебая-Хюккеля:
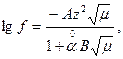 (10)
(10)
де А, В – констати розчинника; z – заряд йона; μ – йонна сила розчину; 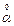 - величина, яка залежить від ефективного діаметра йона (додаток, табл.5, 6, 7).
- величина, яка залежить від ефективного діаметра йона (додаток, табл.5, 6, 7).
Дата добавления: 2016-05-16; просмотров: 531;
