РОЗРАХУНКОВА РОБОТА №1.
ДОСЛІДЖЕННЯ СКЛАДУ ПРИРОДНИХ ВОД І ОЦІНКА ЇХ ПРИДАТНОСТІ ДЛЯ РИБОГОСПОДАРСЬКОЇ ДІЯЛЬНСОТІ
Теоретичний вступ
Природні води характеризуються:
1. Мінералізацією – сумою всіх знайдених при аналізі мінеральних речовин в мг/л або г/кг (при сумі більше одного г/кг), які містяться у даній воді або сумою йонів (∑і), тобто сумою всіх видів йонів в мг/л або г/кг, концентрація яких більша за 0,1 мг/л.
За ступенем мінералізації природні води класифікують (за О.Альокіним) так:
1) дуже прісні (<0,2 г/л);
2) прісні ( 0,2-1,0 г/л);
3) солонуваті (1,0-3,0 г/л);
4) солоні (3,0-35,0 г/л);
5) перехідні до розсолів (35,0-100,0 г/л);
6) розсоли (>100,0 г/л).
2. Лужністю, яка визначається як сума еквівалентних концентрацій аніонів слабких кислот (переважно НСО3- і СО32-), ммоль-екв/л.
3. Твердістю, яка дорівнює сумі еквівалентних концентрацій катіонів Са2+ і Mg2+ у воді, ммоль-екв/л.
4. Окиснюваністю, тобто наявністю речовин, що окиснюються; визначається за кількістю кисню (мг/л), витраченого на їх окиснення в стандартних умовах; розрізняють перманганатну та дихроматну окиснюваність в залежності від окисника (KMnO4 або K2Cr2O7).
При вираженні концентрації йонів в еквівалентній формі, число еквівалентів катіонів в розчині повинно дорівнювати числу еквівалентів аніонів. При добре виконаному аналізі похибка знаходиться в межах 1%. Якщо похибка більша за 5%, а при значній мінералізації – більша за 3%, то аналіз слід вважати недостатньо точним.
Похибка визначається за формулою
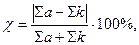
де ∑а – сума аніонів, ∑k – сума катіонів (ммоль-екв/л).
Часто замість визначення йонів Na+ і К+ їх розраховують за різницю сум ммоль-еквіавлентів визначених аніонів і катіонів:
Na+ + K+ = HCO3- + SO42- + Cl- - (Ca2+ + Mg2+).
Для переведення ммоль-екв/л йонів (Na++К+) в мг/л застосовують емпіричний коефіцієнт для прісних вод -25, а для мінералізованих – 24.
При вивченні природних вод дуже важливо знати співвідношення між йонами. Для цього використовують відносний вміст йонів, який виражений у відсотках кількості речовини еквівалента йона від загальної суми кількості речовини еквівалентів усіх йонів у даній воді.
Кількість речовини еквівалентів катіонів і аніонів приймається за 100%. Отже, відносний еквівалентний вміст будь-якого з йонів визначається за формулою
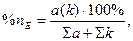
де а – вміст аніона, k – вміст катіона (ммоль-екв/л).
Класифікація природних вод за хімічним складом запропонована О.Альокіним. Відповідно до неї природні води поділяють на три класи за переважаючим аніоном: 1) карбонатний або гідрогенкарбонатний (С); 2) сульфатний (S), хлоридний (С1).
За переважаючим катіоном класи діляться на такі групи:
а) кальцієву (Са);
б) магнієву (Mg);
в) натрієву (Na);
г) натрієво-калієву (Na+K).
За співвідношенням катіонів та аніонів (ммоль-екв/л) води діляться на такі типи:
І тип: характеризується співвідношенням HCO3- > Ca2+ + Mg2+. До цього типу належать м’які води з переважанням йонів Na+ та К+.
ІІ тип: HCO3- < Ca2+ + Mg2+< HCO3- + SO42-. До цього типу належать води більшості річок, озер, підземні води з малим і середнім солевмістом.
ІІІ тип: HCO3- + SO42- < Ca2+ + Mg2+, або С1->Na+. Це води морів, океанів, сильно мінералізовані підземні води.
IV тип: НСО3- = 0. До цього типу належать кислі води – шахтні, болотні.
Склад води можна охарактеризувати відповідною формулою. Наприклад, гідрогенкарбонатний клас, група Са, тип ІІ, твердість 5 ммоль-екв/л (з точністю до одиниц), сума йонів 0,4 г/л (з точністю до 0,1 г/л): 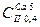 .
.
Склад досліджуваної води можна також виразити формулою Курлова. Формула Курлова – це псевдодріб, у чисельнику якого зліва направо записуються аніони (у відсотках nЕ в 1л води) в порядку зменшення. У знаменнику таким же способом записуються катіони. Зліва від дробу дається загальна мінералізація в г/л. Наприклад, склад води Басівкутського озера в період літньо-осінньої межені можна виразити так:
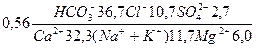 .
.
Дата добавления: 2016-05-16; просмотров: 620;
