Розрахункова частина
Оцінити стан карбонатно-кальцієвої системи заданої річки за середньою багаторічною концентрацією головних йонів. Результати обчислень представити в табличній формі за зразком:
| Річка | Са2+ | Mg2+ | Na+ + K | НCО3- | SO42- | Cl- | CO2 | 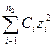
|
| ρ, мг/л | ||||||||
| M, г/моль | ||||||||
| СМ, моль/л |
Порядок виконання роботи:
1. Знайти йонну силу розчину за рівнянням (8).
2. Розрахувати коефіцієнти активності йонів Са2+ і гідроген- карбонат-йонів за формулою (9 або 10).
3. Знайти за таблицею (додаток, табл.7) константи карбонатно-кальцієвої рівноваги: 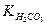 ;
; 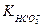 ;
; 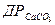 .
.
4. Розрахувати величину КT за рівнянням (6), використовуючи аналітичні дані.
5. Знайти теоретичну величину КТ з рівняння (7).
6. Оцінити стан карбонатно-кальцієвої системи з відношення КЕ до КТ. 
РОЗРАХУНКОВА РОБОТА №3.
ОЦІНКА СТАНУ СУЛЬФАТНО-
КАЛЬЦІЄВОЇ СИСТЕМИ
Теоретичний вступ
Рівновага між твердою фазою CaSO4 і її водним розчином визначається добутком розчинності кальцій сульфату 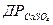 . В рівноважній системі СaSO4 L Ca2+ + SO42- при заданих температурі, тиску і йонно-сольовому складі води величина
. В рівноважній системі СaSO4 L Ca2+ + SO42- при заданих температурі, тиску і йонно-сольовому складі води величина 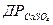 є сталою:
є сталою:
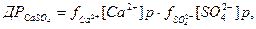 (1)
(1)
де 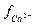 і
і 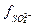 - коефіцієнти активності йонів; [Ca2+]р і [SO42-]р – рівноважні молярні концентрації відповідних йонів.
- коефіцієнти активності йонів; [Ca2+]р і [SO42-]р – рівноважні молярні концентрації відповідних йонів.
Коефіцієнти 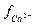 і
і 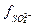 визначаються експериментально в залежності від йонно-сольового складу розчину (див.розрахункову роботу2).
визначаються експериментально в залежності від йонно-сольового складу розчину (див.розрахункову роботу2).
Якщо при підстановці в рівняння (1) фактично знайдених концентрацій Ca2+ і SO42- 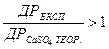 , то вода перенасичена йонами і рівновага зміщена вліво; якщо
, то вода перенасичена йонами і рівновага зміщена вліво; якщо 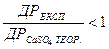 , то рівновага системи зміщена вправо, і вода є агресивною по відношенню до гіпсу. При рівності експериментального і теоретичного коефіцієнтів система CaSO4 – Н2О знаходиться в рівноважному стані.
, то рівновага системи зміщена вправо, і вода є агресивною по відношенню до гіпсу. При рівності експериментального і теоретичного коефіцієнтів система CaSO4 – Н2О знаходиться в рівноважному стані.
Нестачу або надлишок кальцій сульфату в природних водах в молярній формі можна визначити за рівняннями:
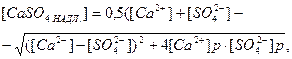 (2)
(2)
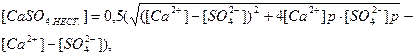 (3)
(3)
де [Ca2+], [SO42-] - молярні концентрації йонів у розчині; [Ca2+]р - [SO42-]р – рівноважні молярні концентрації йонів у даному розчині.
Добуток [Ca2+]р . [SO42-]р знаходиться з рівняння (1). Кількість йонів Кальцію і сульфат-йонів, яка залишилась у розчині після осадження надлишку СaSO4, визначається за формулами:
[Ca2+]p = [Ca2+] – [CaSO4]НАДЛ.; (4)
[SO42-] = [SO42-] –[CaSO4]НАДЛ.. (5)
Дані завдання і розрахунки внести у таблицю за зразком:
| Річка t0C= | Са2+ | Mg2+ | Na+ + K+ | HCO3- | SO42- | Cl- | Σi |
| ρ, мг/л | |||||||
| М, г/моль | |||||||
| СМ, моль/л |
ІV. ТЕРМІНОЛОГІЧНИЙ СЛОВНИК
Абіотичні чинники -кліматичні та фізико-хімічні чинники: температура, світло, водообмін, прозорість води, її каламутність, мінералізація, газовий режим (вміст кисню, вуглекислого газу, рН), біогенні елементи, мікроелементи, органічна речовина в зваженому та розчиненому стані.
Автохтонна – це органічна речовина, яка утворюється головним чином, завдяки життєдіяльності фітоплактона, а також органічна речовина бактерій, зооплактона і риб.
Агресивні води– це води, які містять надлишок вільної карбонатної кислоти над рівноважною.
Алохтонна– це органічна речовина, яка утворилась за межами даної водойми. В її складі переважає водний гумус – гумусові сполуки та фульвокислоти.
Амфотерні гідроксиди(амфоліти) мають властивості і основ, і кислот, тому взаємодіють з утворенням солей і з кислотами, і з лугами.
Біогенні речовини- це речовини, необхідні для життєдіяльності водних організмів, і є продуктами їх життєдіяльності.
Біотичні чинники– чинники органічного світу, взаємодія між організмами (між хижаками і жертвою), забезпечення їжою.
Буферні розчини– розчини, рН яких не змінюється при додаванні невеликої кількості сильної кислоти або лугу.
Буферна ємність– визначається числом еквівалентів сильної кислоти або лугу, яке треба додати до 1л буферного розчину, щоб змінити рН на одиницю.
Відновні процесивідбуваються у відсутності кисню. Показником його відсутності є наявність двовалентного Феруму.
Вільна карбонатна кислота– це розчинений у воді вуглекислий газ і карбонатна кислота, яка утворилась при взаємодії вуглекислого газу з водою.
Вільна лужність– обумовлена наявністю вільних лугів і розчинених солей – карбонатів, силікатів, сільфідів, рН води > 8,3.
Вільна кислотність– та частина загальної кислотності, при якій знижується рН води до 4,5 і нижче. Обумовлена наявністю сильних кислот і солей, утворених слабкими основами і сильними кислотами.
Водневий показник рНхарактеризує активну кислотність, тобто концентрацію реально присутніх у воді йонів Гідрогену.
Гідроксид ний показник рОНхарактеризує активну лужність, тобто концентрацію реально присутніх у воді гідроксид- йонів.
Гомогенна система– це система, яка складається з однієї фази.
Гетерогенна система– це система, яка складається з декількох фаз.
Гумус– комплекс органічних сполук, який утворюється при недостатньому доступі кисню.
Дисперсні системи– це системи, в яких одна речовина рівномірно розподілена у вигляді частинок різного розміру в іншій.
Добуток розчинності– добуток концентрацій йонів в насиченому розчині малорозчинного електроліту при даній температурі.
Електроліти– речовини, які проводять електричний струм в розчиненому або розплавленому стані.
Зв’язанакарбонатна кислота знаходиться у водоймі у вигляді гідроген карбонат – та карбонат - йонів.
Істинний розчин– це однорідна система, в якій розмір частинок менший за 1нм (1нм = 10-9м).
Йонний добуток води( 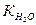 ) – добуток молярних концентрацій йонів Н+ та ОН+ для води і всіх водних розчинів. Це величина стала і дорівнює 10-14 при 250С.
) – добуток молярних концентрацій йонів Н+ та ОН+ для води і всіх водних розчинів. Це величина стала і дорівнює 10-14 при 250С.
Катіонний обмін– результат взаємодії, з одного боку, тонко- дисперсної ( глинистої) частини гірських порід, а з другого, - водного розчину, який містить різні катіони.
Кислоти– це електроліти, які дисоціюють в розчинах з відщепленням йонів Гідрогену.
Кислотність води– це вміст у воді речовин, які реагують з лугами – натрій гідроксидом та калій гідроксидом.
Компонент– це кожна хімічно однорідна речовина, яка міститься в системі і може існувати в ізольованому виді після виділення з системи.
Константа дисоціації– константа рівноваги оборотного процесу дисоціації слабкого електроліту.
Кларк– це масовий відсоток вмісту елемента в породі.
Лужність води- це вміст у воді речовин, які реагують з сильною кислотою (НСІ). Звичайно лужність природних вод обумовлена наявністю гідроген карбонатів лужних та лужноземельних металів, і значення рН таких вод не перевищує 8,3.
Міграційна здатність– це здатність йонів переміщуватись у водному середовищі, яка залежить від фізико-хімічних констант йона та умов середовища.
Мікроелементи– елементи, сполуки яких зустрічаються в природних водах в дуже малих кількостях – менше 1мл/л.
Мінералізація- розпад органічної речовини в природних водах, в результаті якого утворюються амоняк, вуглекислий газ і вода.
Мінералізація води– це загальний вміст у воді всіх знайдених під час аналізу мінеральних речовин в мг/л або г/кг (при сумі більше
1 г/кг)
Насичений розчин– це розчин, який перебуває в рівновазі з розчиненою речовиною.
Ненасичений– це розчин, в якому при даних умовах ще може розчинитись деяка кількість речовин.
Нестабільні води– це води, які містять надлишкову кількість ( над рівновагою) гідрогенкарбонатів, тобто мають підвищену лужність.
Нітрифікація– це процес, який відбувається під дією бактерій і проходить в дві фази. Перша фаза – перехід NH4+ в NO2- здійснюється під дією бактерій- нітрифікаторфі (Nitrosomonas). Друга фаза – окиснення нітритних йонів під дією інших бактерій (Nitrobacter) в нітратні.
Окиснюваність води– величина, яка вимірюється кількістю кисню, який витрачається на окислення органічних і деяких неорганічних речовин, що містяться в 1л води.
Окиснювальні процеси– відбуваються в присутності у водах вільного кисню. Показником його присутності є тривалентний Ферум.
Осмос– це одностороння самовільна дифузія молекул розчинника через напівпроникну мембрану в розчин або з розчину з низькою концентрацією в розчині з високою концентрацією.
Основа– це електроліти, що дисоціюють в розчинах з відщепленням гідроксид-йонів.
Природна кислотність– частина кислотності, яка зумовлена присутністю гумінових та інших слабких кислот, розчинених у воді.
Розчинність– це здатність речовин розчинятись в тому чи іншому розчиннику. Мірою розчинності є маса речовин, яка може розчинитись в 100г розчинника приданій температурі з утворенням насиченого розчину.
Стабільні води– це води, в яких існує основна карбонатна рівновага.
Ступінь дисоціації– це відношення числа моль, що розпались на йони, до загального числа моль в розчині електроліта.
Сульфаторедукція– це відновлення до сірководню сульфатних йонів в анаеробних умовах в присутності органічної речовини під дією бактерій (Місrospira).
Сума йонів– арифметична сума всіх видів йонів, концентрація яких перевищує 0,1 мг/л, в мг/л або г/л досліджуваної води .
Твердість води– характеризується сумою ммольекв йонів Са2+ та Mg2+, які містяться в одному літрі води.
Твердість залишкова– різниця між карбонатною і тимчасовою твердістю.
Твердість карбонатнаобумовлена присутністю гідроген-карбонатів кальцію і магнію.
Твердість некарбонатна– обумовлена наявністю сульфатів, хлоридів та інших солей Са2+ та Mg2+.
Твердість тимчасова– твердість, яка усувається при кип’ятінні.
Фаза– частина системи, відокремлена від інших її частин поверхнею поділу.
Дата добавления: 2016-05-16; просмотров: 737;
