Возможность образования двух и более видов молекул, содержащих различное число атомов
Строение вещества
Одним из основных понятий химии и других естественных наук является атом. Этот термин имеет давнее происхождение; он насчитывает уже около 2500 лет. Впервые понятие атома зародилось в Древней Греции, примерно в V в. до н. э. Основоположниками атомистического учения были древнегреческие философы Левкипп[1] и его ученик Демокрит. Именно они выдвинули идею о дискретном строении материи и ввели термин «АТОМ». Демокрит определял атом как наименьшую, далее неделимую, частицу материи.
Учение Демокрита не получило широкого распространения, и в течение большого исторического периода в химии (а во времена средневековья –
алхимии) господствовала теория Аристотеля (384 – 322 гг. до н. э.). Согласно учению Аристотеля, основными началами природы являются абстрактные «принципы»: холод, тепло, сухость и влажность, при комбинации которых образуются четыре основных «элемента-стихии»: земля, воздух, огонь
и вода.
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге «Химик-скептик» он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. Л. Пруст (закон постоянства состава) и многие другие.
Открытия в области физики, сделанные в конце XIX – первой трети ХХ столетий, заставили ученых совершенно иначе смотреть на атомно-молекулярное учение. Оказалось, что атом обладает сложным строением и не является наименьшей частицей материи.
Здесь мы не будем приводить устаревшее определение этого понятия, а сразу дадим формулировку, базирующуюся на современных представлениях.
Атом (греч. atomoz – неделимый) – это наименьшая частица химического элемента, способная к самостоятельному существованию и являющаяся носителем его свойств. Атом представляет собой электронейтральную микросистему, состоящую из положительно заряженного ядра и соответствующего числа электронов.
Химический элемент – вид атомов с одинаковым зарядом ядра.
Химический элемент – это понятие, а не материальная частица. Это не атом, а совокупность атомов, характеризующихся определенным признаком – одинаковым зарядом ядра.
Электрон [др.греч. hlektron – янтарь (хорошо электризуется при трении)] – стабильная элементарная частица, имеющая массу покоя, равную 9,109 × 10–31 кг = 5,486 × 10–4 а. е. м.[2], и несущая элементарный отрицательный заряд, равный 1,6 × 10–19 Кл.
В химии и в физике при решении многих задач заряд электрона принимают за – 1 и заряды всех остальных частиц выражают в этих единицах. Электроны входят в состав всех атомов.
Протон (греч. prwtos – первый) – элементарная частица, являющаяся составной частью ядер атомов всех химических элементов, обладает массой покоя mp =1,672 × 10–27 кг = 1,007 а. е. м. и элементарным положительным электрическим зарядом, равным по величине заряду электрона, т. е. 1,6 × 10–19 Кл.
Число протонов в ядре определяет порядковый номер химического элемента.
Нейтрон (лат. neutrum – ни то, ни другое) – электрически нейтральная элементарная частица с массой покоя, несколько превышающей массу покоя протона mn = 1,675 × 10–27 кг = 1,009 а. е. м.
Наряду с протоном нейтрон входит в состав всех атомных ядер (за исключением ядра изотопа водорода 1Н, представляющего собой один протон).
Таблица 1Некоторые характеристики элементарных частиц, входящих в состав атома
| Элементарная частица | Обозначение | Масса | Электрический заряд | ||
| в ед. СИ(кг) | в а. е. м. | в Кл | в зарядах электрона | ||
| Электрон | e– | 9,109 × 10–31 | 5,468 × 10–4 | 1,6 × 10–19 | –1 |
| Протон | p | 1,672 × 10–27 | 1,007 | 1,6 × 10–19 | |
| Нейтрон | n | 1,675 × 10–27 | 1,009 |
Обобщающее (групповое) название протонов и нейтронов – нуклоны.
Массовое число – общее число нуклонов (протонов и нейтронов) в ядре.
Ядро атома состоит из протонов, число которых равно порядковому номеру элемента (Z), и нейтронов (N). A = Z + N, где A – массовое число.
Нуклиды (лат. nucleus – ядро) – общее название атомных ядер, характеризуются определенным числом протонов и нейтронов (величиной положительного заряда и массовым числом).
Для того чтобы указать химический элемент, достаточно назвать только одну величину – заряд ядра, т. е. порядковый номер элемента в Периодической системе. Для определения нуклида этого недостаточно – надо указать также и его массовое число.
Иногда, не совсем точно, понятие «нуклид» относят не к самому ядру, а ко всему атому.
Изотопы (греч. isoz – одинаковый + topoz – место) – нуклиды, имеющие одинаковое число протонов, но различающиеся массовыми числами.
Изотопы – нуклиды, занимающие одно и то же место в Периодической системе, т. е. атомы одного и того же химического элемента.
Например: 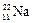 ,
,  ,
, 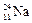 – изотопы натрия.
– изотопы натрия.
Изобары (греч. izo – равный + baros – вес) – нуклиды, имеющие одинаковые массовые числа, но различное число протонов (т. е. относящиеся к различным химическим элементам), например, 90Sr, 90Y, 90Zr.
Изотоны – нуклиды с одинаковым числом нейтронов.
Довольно долго химики не делали четкого различия между атомами и молекулами простых веществ. В 1811 г. А. Авогадро предложил гипотезу, которая позволяла однозначно определить эти понятия, однако современники ее не оценили, и она получила признание только в 1860 г., после состоявшегося в Карлсруэ (Германия) первого международного съезда химиков, когда молекула стала пониматься как мельчайшая частица вещества, участвующая в его химических превращениях. По мере развития естественных наук определение молекулы претерпело некоторые изменения.
Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества, определяющая его свойства. Состоит из атомов одного или различных химических элементов и существует как единая система атомных ядер и электронов. В случае одноатомных молекул (например, благородных газов) понятия атома и молекулы совпадают.
Атомы удерживаются в молекуле с помощью химических связей.
В химии, кроме атомов и молекул, приходится рассматривать и другие структурные единицы: ионы и радикалы.
Ионы (греч. ion – идущий) – электрически заряженные частицы, образовавшиеся из атомов (или атомных групп) в результате присоединения или потери электронов.
Положительно заряженные ионы называются катионами (греч. kata – вниз + ион), отрицательно заряженные – анионами (греч. ana – вверх + ион).
Например, K+ – катион калия, Fe2+ – катион железа, 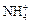 – катион аммония, Cl– – анион хлора (хлорид-анион), S2– – анион серы (сульфид-анион),
– катион аммония, Cl– – анион хлора (хлорид-анион), S2– – анион серы (сульфид-анион), 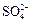 – сульфат-анион.
– сульфат-анион.
Радикалы (лат. radicalis – коренной) – частицы (атомы или группы атомов) с неспаренными электронами.
Они обладают высокой реакционной способностью. Например, H × – радикал водорода, Cl × – радикал хлора, × CH3 – радикал-метил. В то же время парамагнитные молекулы, например, O2 , NO, NO2 , имеющие неспаренные электроны, не являются радикалами.
Простое вещество – вещество, состоящее из атомов одного химического элемента.
Простое вещество – это форма существования химического элемента. Многие элементы могут существовать в виде нескольких простых веществ, например, углерод (графит, алмаз, карбин, фуллерены), фосфор (белый, красный, черный), кислород (озон, кислород).
Известно около 400 простых веществ.
Аллотрóпия (греч. allos – другой + trope – поворот) – способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся количеством атомов в молекуле (например, O2 и O3) или разной структурой кристаллов (графит и алмаз).
Полиморфизм (греч. polimorjos – многообразный) – способность твердых веществ существовать в двух или нескольких формах с различной кристаллической структурой и различными же свойствами. Такие формы называются полиморфными модификациями.
Например, FeS2 может образовывать два вещества с различными кристаллическими структурами (полиморфные модификации): одно называется пирит, а другое – марказит. Являются ли эти вещества аллотропными модификациями? Не являются.
Аллотропия относится только к простым веществам и рассматривает как различие в составе их молекул, так и различие в строении кристаллических решеток. Если речь идет о различии в строении кристаллических решеток простых веществ, то понятия полиморфизм и аллотропия совпадают, например, о графите и алмазе можно сказать, что это аллотропные формы, а можно – полиморфные формы.
Возможность образования двух и более видов молекул, содержащих различное число атомов
Кислород. Образует две аллотропные формы: O2 и O3 – озон. Они различаются как по физическим, так и по химическим свойствам.
Кислород O2 – бесцветный газ, без запаха. Озон O3 – газ голубого цвета с характерным запахом (даже свое название он получил от греч. wzein (ozein) – пахнуть).
В жидком и твердом состояниях кислород окрашен в бледно-голубой цвет. Озон в жидком состоянии интенсивно окрашен в фиолетовый цвет, в твердом состоянии имеет черно-фиолетовый цвет.
Кислород парамагнитен, озон диамагнитен.
Таблица 2
Температуры фазовых переходов О2 и О3
| Ткипения,°С | Тплавления,°С | плотность, г/см3 | |
| О2 | -182,8 | -218,2 | ж. 1,14 |
| О3 | -112 | -193 | ж. 1,51 |
По химической активности кислород и озон резко различаются. Озон более реакционноспособен, чем кислород, и проявляет более сильные окислительные свойства.
Несмотря на то, что кислород взаимодействует почти со всеми элементами в свободном виде, во многих случаях эти реакции протекают только при повышенной температуре. Озон же реагирует со многими веществами в таких условиях, когда кислород остается инертным, например,
O3 + 2 KI + H2O = O2 + I2 + 2 KOH
PbS + 2 O3 = PbSO4 + O2
Озон окисляет ртуть и серебро в оксиды.
Фосфор. Известны две аллотропные формы фосфора: белая и красная. Белый фосфор состоит из тетраэдрических молекул P4 . Красный фосфор можно рассматривать как полимерные молекулы P. Безусловно, в твердом состоянии эти модификации отличаются и строением кристаллических решеток, и физическими свойствами.
Все аллотропные формы фосфора также проявляют значительное различие и в химических свойствах, которые, прежде всего, заключаются в их различной реакционной способности. Белый фосфор – более активная, а красный – менее активная формы.
Белый фосфор медленно окисляется на воздухе уже при обычной температуре (чем обусловлено свечение белого фосфора), в то время как красный устойчив на воздухе и загорается только при нагревании.
Дата добавления: 2016-02-13; просмотров: 1264;
