I. Нарушение образования импульса
А. Нарушения автоматизма СА-узла (номотопные аритмии):
синусовая тахикардия;
синусовая брадикардия;
синусовая аритмия;
синдром слабости синусового узла.
Б. Эктопические (гетеротопные) ритмы, обусловленные преобладанием автоматизма эктопических центров:
1) медленные (замещающие) выскальзывающие комплексы и ритмы;
а) предсердные;
б) из АВ — соединения;
в) желудочковые.
2) ускоренные эктопические ритмы (непароксизмальные тахикардии):
а) предсердные;
б) из АВ — соединения;
в) желудочковые.
3) миграция суправентрикулярного водителя ритма.
В. Эктопические (гетеротопные) ритмы, преимущественно обусловленныене механизмом повторного входа волны возбуждения:
1) Экстрасистолия:
а) предсердная;
б) из АВ–соединения;
в) желудочковая.
2) Пароксизмальная тахикардия:
а) предсердная;
б) из АВ–соединения;
в) желудочковая.
3) Трепетание предсердий.
4) Мерцание (фибрилляция) предсердий.
5) Трепетание и мерцание (фибрилляция) желудочков.
II. Нарушения проводимости:
1) Синоатриальная блокада.
2) Внутрипредсердная (межпредсердная) блокада.
3) Атриовентрикулярная блокада:
а) I степени;
б) II степени;
в) III степени (полная).
4) Внутрижелудочковые блокады (блокады ветвей пучка Гиса):
а) одной ветви (однопучковые, или монофасцикулярные);
б) двух ветвей (двухпучковые, или бифасцикулярные);
в) трех ветвей (трехпучковые, или трифасцикулярные).
5) Асистолия желудочков.
6) Синдром преждевременного возбуждения желудочков:
а) синдром Вольфа–Паркинсона–Уайта (WPW);
б) синдром укороченного интервала P-Q(R) (CLC).
III. Комбинированные нарушения ритма:
1) Парасистолия.
2) Эктопические ритмы с блокадой выхода.
3)Атриовентрикулярные диссоциации.
Таблица 3.3
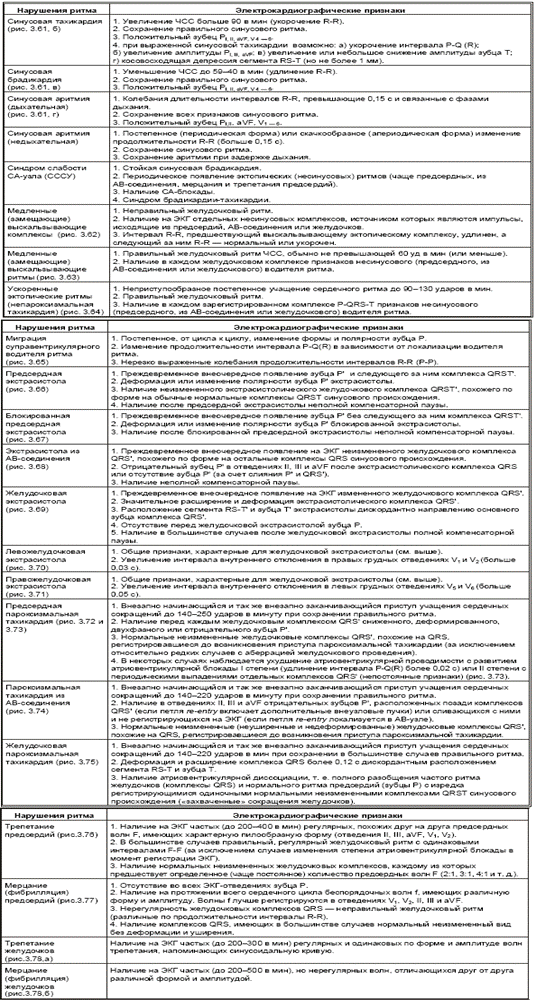
Электрокардиографические признаки I группы аритмий, обусловленных нарушением образования импульса
В табл. 3.3. приведены электрокардиографические признаки первой группы аритмий, обусловленных нарушениями образования импульса. Перед тем как пользоваться этой таблицей, вспомните значение нескольких терминов, используемых при описании нарушений ритма и проводимости.
Экстрасистолия (ЭС)—преждевременное возбуждение всего сердца или какого-либо его отдела.
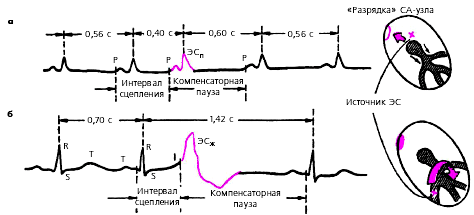
Интервал сцепления—расстояние от предшествующего экстрасистоле очередного цикла P-QRST основного ритма до экстрасистолы (рис. 3.58).
Компенсаторная пауза—расстояние от экстрасистолы до следующего за ней цикла P-QRST основного ритма. Неполная компенсаторная пауза—это пауза, возникающая после предсердной экстрасистолы или экстрасистолы из АВ-соединения, длительность которой чуть больше обычного интервала P-P (R-R) основного ритма (рис. 3.58, а).
Неполная компенсаторная пауза включает время, необходимое для того, чтобы эктопический импульс достиг СА-узла и «разрядил» его, а также время, которое требуется для подготовки в нем очередного синусового импульса. Полная компенсаторная пауза—пауза, возникающая после желудочковой экстрасистолы, длительность которой равна удвоенному интервалу R-R основного ритма (рис. 3.58, б).
|
| Рис. 3.58. Измерение интервала сцепления и длительности компенсаторной паузы при а - предсердной и б - желудочковой экстрасистолии |
Ранние экстрасистолы—ЭС с очень малым интервалом сцепления, когда начальная часть экстрасистолы наслаивается на зубец Т предшествующего ЭС очередного комплекса QRST.
Групповая (залповая) экстрасистолия—наличие на ЭКГ трех и более ЭС подряд.
Монотопная экстрасистолия—ЭС, исходящие из одного эктопического источника.
Политопная экстрасистолия—ЭС, исходящие из разных эктопических очагов.
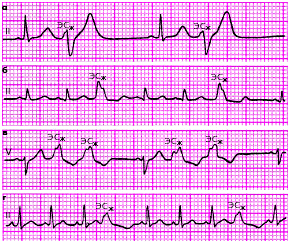
Аллоритмия — правильное чередование ЭС и нормальных (например синусовых) комплексов P-QRST (бигеминия, тригеминия, квадригеминия и т. п.) (рис. 3.59).
|
| Рис. 3.59. Различные варианты желудочковой аллоритмии. а - бигеминия, б, в - тригеминия, г - квадригеминия |
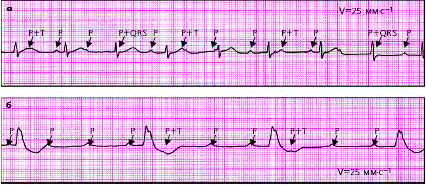
Блокированные предсердные ЭС—экстрасистолы, исходящие из предсердий, которые представлены на ЭКГ только зубцом Р, после которого отсутствует экстрасистолический желудочковый комплекс QRST'.
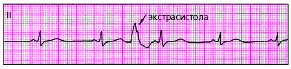
Вставочная (интерполированная) экстрасистола — ЭС, которая как бы вставлена между двумя обычными желудочковыми комплексами QRS без какой бы то ни было компенсаторной паузы (рис. 3.60).
|
| Рис. 3.60. ЭКГ при вставочной (интерполированной) желудочковой экстрасистоле. Компенсаторная пауза отсутствует |
Угрожающие желудочковые экстрасистолы (ЖЭ) — экстрасистолы, которые нередко являются предвестниками более тяжелых нарушений ритма (пароксизмальной желудочковой тахикардии, фибрилляции или трепетания желудочков). К угрожающим желудочковым экстрасистолам (ЖЭ) относятся: 1) частые; 2) политопные; 3) парные (групповые) и 4) ранние ЖЭ.
Атриовентрикулярная диссоциация (АВ-диссоциация)—полная (или почти полная) разобщенность в деятельности предсердий и желудочков, возникающая при желудочковой пароксизмальной тахикардии в результате увеличения рефрактерности АВ-соединения и невозможности проведения к желудочкам синусовых импульсов.
Дискордантность—разнонаправленность, например, алгебраической суммы зубцов комплекса QRS и сегмента RS-T (или/и зубца Т). Конкордантность—однонаправленность, например, алгебраической суммы зубцов комплекса QRS и сегмента RS-T (зубца Т).
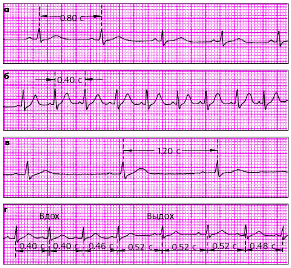
|
| Рис. 3.61. Номотопные нарушения ритма. а - ЧСС - 75 в мин, б - синусовая тахикардия (ЧСС - 150 в мин), синусовая брадикардия (ЧСС - 50 в мин), г - синусовая (дыхательная) аритмия |
На рис. 3.62–3.78 приведены примеры электрокардиограмм при нарушениях ритма сердца. Возможности диагностики нарушений ритма сердца с помощью метода длительного мониторирования ЭКГ по Холтеру описаны ниже.
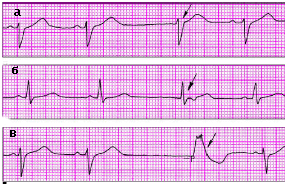
|
| Рис. 3.62 . ЭКГ больных с медленными (замещающими) выскальзывающими эктопическими комплексами. а, б - выскальзывающие комплексы из АВ-соединения, в - выскальзывающий комплекс из желудочка |
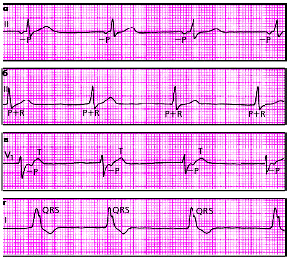
|
| Рис. 3.63. ЭКГ больных с медленными (замещающими) выскальзывающими ритмами. а - предсердный ритм, б - ритм из АВ-соединения с одновременным возбуждением предсердий и желудочков, в - ритм из АВ-соединения с возбуждением желудочков, предшествующим возбуждению предсердий, г - желудочковый (идиовентрикулярный) ритм |
|
| Рис. 3.64. Ускоренные эктопические ритмы, или непароксизмальные тахикардии а - ускоренный предсердный ритм, б - ускоренный ритм из АВ-соединения с одновременным возбуждением желудочков и предсердий, в - желудочковый (идиовентрикулярный) ускоренный ритм |
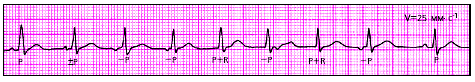
|
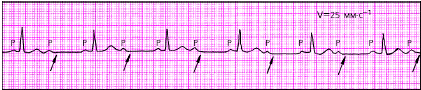
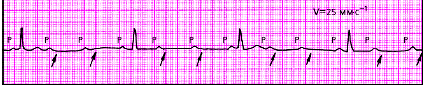
| Рис. 3.65. ЭКГ больного с миграцией суправентрикулярного водителя ритма |
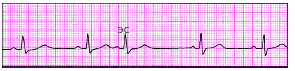
|
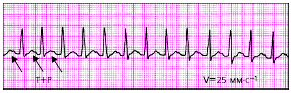
| Рис. 3.66. Предсердная экстрасистола (ЭС) |
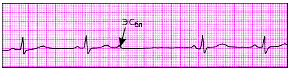
|
| Рис. 3.67. Блокированная предсердная экстрасистола (ЭСбл) |
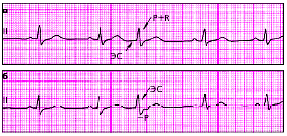
|
| Рис. 3.68. Экстрасистолы из АВ-соединения с одновременным возбуждением предсердий и желудочков (а) и более ранним возбуждением желудочков (б) |
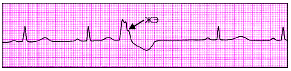
|
| Рис. 3.69. Желудочковая экстрасистола (ЖЭ) |
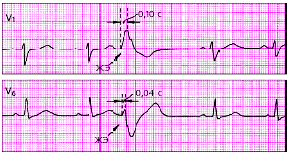
|
| Рис. 3.70. Левожелудочковая экстрасистола. Интервал внутреннего отклонения увеличен в отведении V1 до 0,10 с |
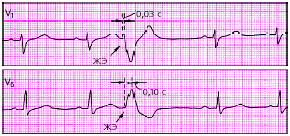
|
| Рис. 3.71. Правожелудочковая экстрасистола. Интервал внутреннего отклонения увеличен в отведении V6 до 0,10 с |
|
| Рис. 3.72. Предсердная пароксизмальная тахикардия. Зубцы Р наслаиваются на зубцы Т |
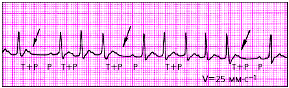
|
| Рис. 3.73. Предсердная пароксизмальная тахикардия с преходящей АВ-блокадой II степени и выпадением отдельных комплексов QRS |
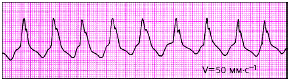
|
| Рис. 3.74. Пароксизмальная тахикардий из АВ-соединения с одновременным возбуждением предсердий и желудочков |
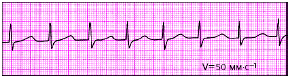
|
| Рис. 3.75. Пароксизмальная желудочковая тахикардия |
|
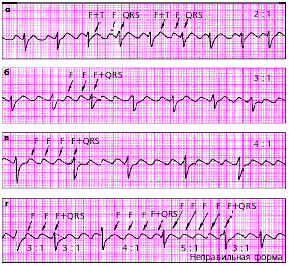
| Рис. 3.76. ЭКГ при трепетании предсердий. а - правильная форма с функциональной АВ-блокадой (2:1), б - правильная форма (3:1), в - правильная форма (4:1), г - неправильная форма с изменением степени АВ-блокады (3:1, 4:1, 5:1) |
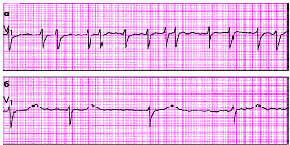
|
| Рис. 3.77. ЭКГ при тахисистолической (а) и брадисистолической (б) формах мерцания (фибрилляции) предсердий |
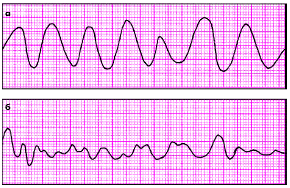
|
| Рис. 3.78. ЭКГ при трепетании (а) и фибрилляции (б) желудочков |
Электрокардиограмма при гипертрофии предсердий и желудочков
Разнообразные электрокардиографические изменения, выявляемые при компенсаторной гипертрофии любого отдела сердца, обусловлены:
1.увеличением электрической активности гипертрофированного отдела сердца;
2. замедлением проведения по нему электрического импульса;
3.ишемическими, дистрофическими, метаболическими и склеротическими изменениями в гипертрофированной сердечной мышце.
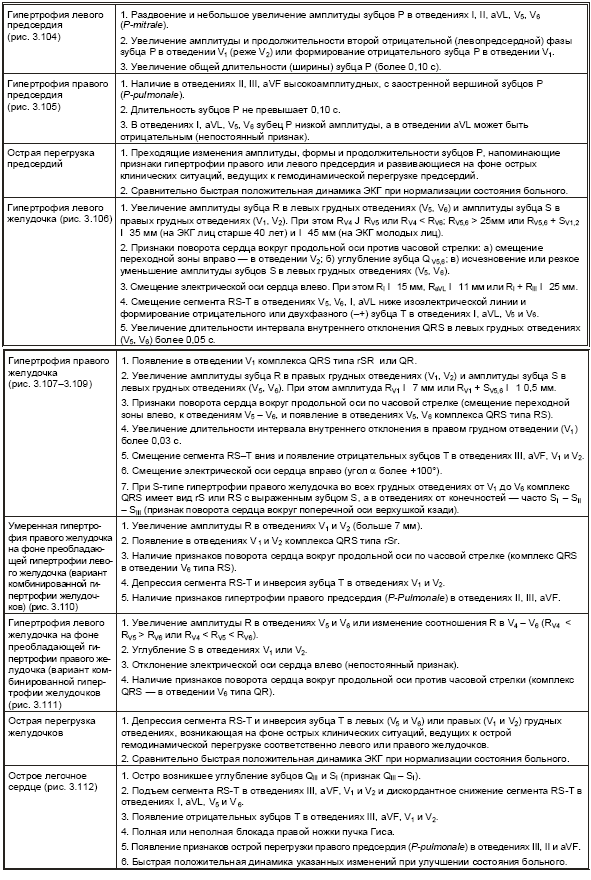
В табл. 3.5. представлены основные электрокардиографические признаки, а на рис. 3.104–3.112 — типичные электрокардиограммы при гипертрофии различных отделов сердца.
Таблица 3.5
Электрокардиографические признаки гиертрофии предсердий и желудочков
|
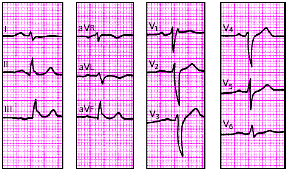
| Рис. 3.104 . ЭКГ при гипертрофии левого предсердия в сочетании с гипертрофией правого желудочка |
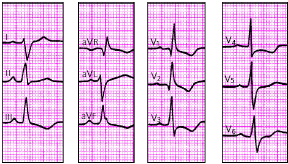
|
| Рис. 3.105. ЭКГ при гипертрофии правого предсердия в сочетании с гипертрофией правого желудочка |
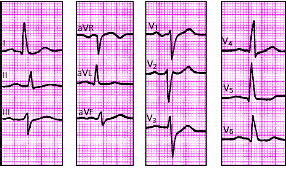
|
| Рис. 3.106. ЭКГ при гипертрофии левого желудочка |
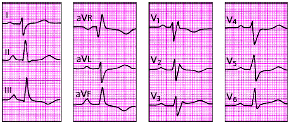
|
| Рис. 3.107. ЭКГ при гипертрофии правого желудочка (тип rSR') |
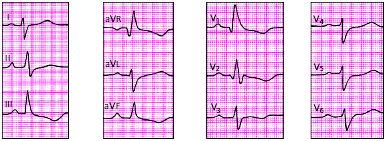
|
| Рис. 3.108. ЭКГ при гипертрофии правого желудочка (тип R) |
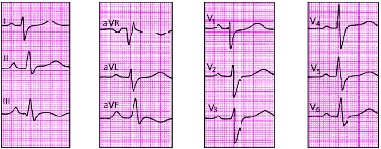
|
| Рис. 3.109. ЭКГ при гипертрофиии правого желудочка (тип S) |
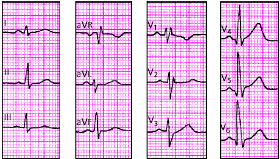
|
| Рис. 3.110. ЭКГ при умеренной гипертрофии правого желудочка на фоне преобладающей гипертрофии левого желудочка |
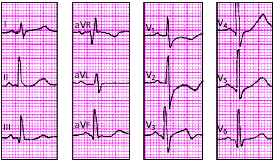
|
| Рис. 3.111. ЭКГ при гипертрофии левого желудочка на фоне преобладающей гипертрофии правого желудочка |
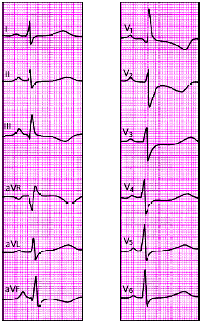
|
| Рис. 3.112. ЭКГ при легочном сердце |
Электрокардиограмма при нарушениях проводимости
В табл. 3.4. приведены электрокардиографические признаки второй группы аритмий, обусловленных нарушениями проведения электрического импульса.
Таблица 3.4
Электрокардиографические признаки аритмий, обусловленных нарушенным проведением импульса
На рис. 3.79–3.103 приведены примеры наиболее часто встречающихся нарушений проводимости.
|
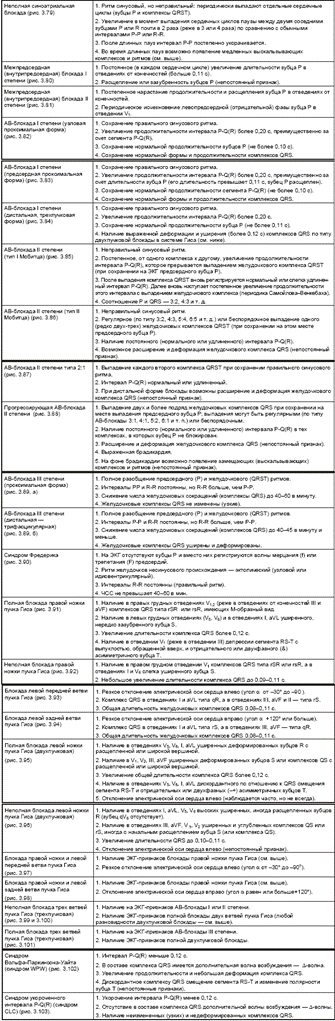
| Рис. 3.79 . Неполная синоатриальная блокада (а) и выскальзывающий комплекс на фоне синоатриальной блокады (б) |
|
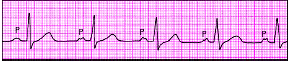
| Рис. 3.80. Межпредсердная (внутрипредсердная) блокада I степени. Заметно постоянное расщепление зубца Р |
|
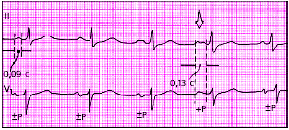
| Рис. 3.81. Межпредсердная (внутрипредсердная) блокада II степени. Стрелкой обозначен момент возникновения максимальной блокады проведения (расщепление зубца РII и исчезновение второй отрицательной фазы зубца РVI) |
|
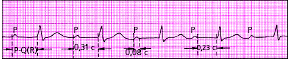
| Рис. 3.82. АВ-блокада I степени (узловая форма) |
|
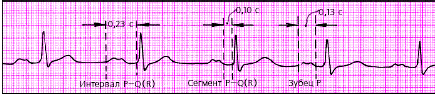
| Рис. 3.83. АВ-блокада I степени (предсердная форма) |
|
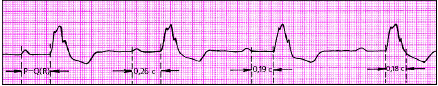
| Рис. 3.84. АВ-блокада I степени (дистальная, трехпучковая форма) |
|
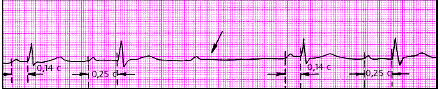
| Рис. 3.85. АВ-блокада II степени (тип I Мобитца, 3:2). Стрелкой указано выпадение желудочкового комплекса |
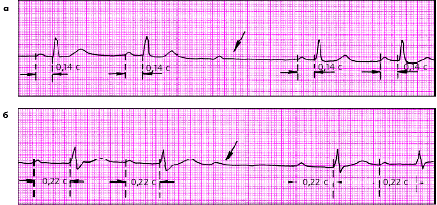
|
| Рис. 3.86. АВ-блокада II степени (тип II Мобитца) с наличием постоянного нормального (а) и увеличенного (б) интервала PQ |
|
| Рис. 3.87. АВ-блокада II степени типа 2:1 |
|
| Рис. 3.88. Прогрессирующая АВ-блокада II степени типа 3:1 |
|
| Рис. 3.89. ЭКГ при проксимальной (а) и дистальной (б) формах АВ-блокады III степени |

|
| Рис. 3.90. Синдром Фредерика (сочетание мерцания предсердий и полной АВ-блокады) |
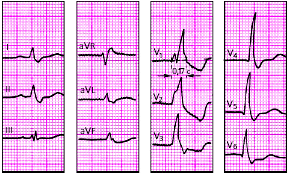
|
| Рис. 3.91. ЭКГ при полной блокаде правой ножки пучка Гиса. Объяснения в тексте |
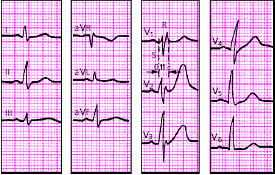
|
| Рис. 3.92. ЭКГ при неполной блокаде правой ножки пучка Гиса. Объяснения в тексте |
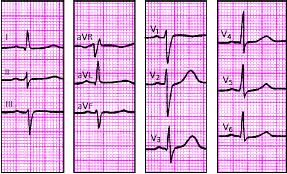
|
| Рис. 3.93. ЭКГ при блокаде левой передней ветви пучка Гиса. Объяснения в тексте |
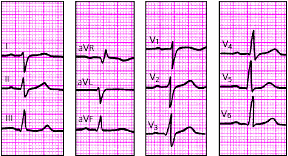
|
| Рис. 3.94. ЭКГ при блокаде левой задней ветви пучка Гиса. Объяснения в тексте |
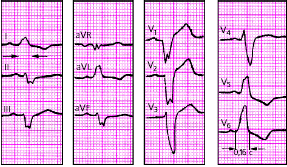
|
| Рис. 3.95. ЭКГ при полной блокаде левой ножки пучка Гиса. Объяснения в тексте |
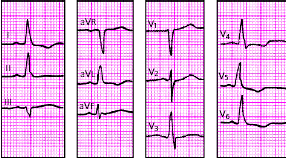
|
| Рис. 3.96. ЭКГ при неполной блокаде левой ножки пучка Гиса. Объяснения в тексте |
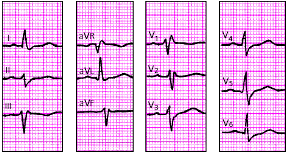
|
| Рис. 3.97. ЭКГ при сочетании неполной блокады правой ножки пучка Гиса и блокады левой передней ветви пучка Гиса. Объяснения в тексте |
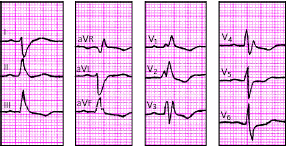
|
| Рис. 3.98. ЭКГ при сочетании блокады правой ножки пучка Гиса и блокады левой задней ветви пучка Гиса. Объяснения в тексте |
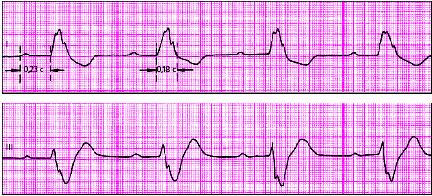
|
| Рис. 3.99. ЭКГ при неполной трехпучковой блокаде в сочетании с АВ-блокадой I степени. Объяснения в тексте |

|
| Рис. 3.100. ЭКг при неполной трехпучковой блокаде в сочетании с АВ-блокадой II степени (4:3) |
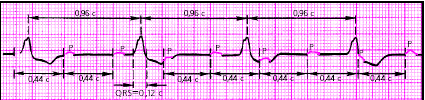
|
| Рис. 3.101. ЭКГ при полной трехпучковой блокаде |
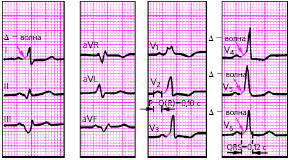
|
| Рис. 3.102. ЭКГ при синдроме WPW |
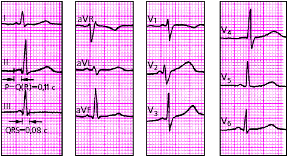
|
| Рис. 3.103. ЭКГ при синдроме укороченного интервала P-Q(R) (синдроме CLC) |
Электрокардиографическая диагностика хронических форм ишемической болезни сердца
При хронической ишемической болезни сердца в сердечной мышце выявляются участки ишемии, ишемического повреждения и, в ряде случаев, рубцовых изменений миокарда, сочетание которых приводит к разнообразным изменениям ЭКГ, зарегистрированной в покое (изменение комплекса QRS, сегмента RS-T и зубца Т, нарушения ритма и проводимости и т. п.), большинство из которых неспецифичны. Относительно достоверным указанием на наличие ИБС является патологический зубец Q или комплекс QS, свидетельствующие о перенесенном в прошлом инфаркте миокарда. Однако и в этих случаях необходимо исключить связь патологического Q (QS) с выраженной гипертрофией желудочков, гипертрофической кардиомиопатией, блокадой ножек пучка Гиса, синдромом WPW и другими электрокардиографическими синдромами.
Нередко, особенно у молодых больных с ишемической болезнью сердца, ЭКГ, зарегистрированная в покое, мало отличается от таковой здоровых людей. В этих случаях для электрокардиографической диагностики ИБС используют функциональные нагрузочные пробы. Чаще других применяют пробу с дозированной физической нагрузкой на велоэргометре или тредмиле, дипиридамоловую пробу, чреспищеводную электростимуляцию предсердий и суточное мониторирование ЭКГ по Холтеру.
Проба с физической нагрузкой
Проба с дозированной физической нагрузкой применяется с целью выявления скрытой коронарной недостаточности, преходящих нарушений ритма сердца и для установления индивидуальной толерантности больных к физической нагрузке.
Физическая нагрузка, как известно, оказывает разнообразное действие на сердечно-сосудистую и дыхательную системы, вызывая, в частности, тахикардию, умеренное повышение артериального давления, увеличение работы сердца и, соответственно, потребности миокарда в кислороде. У здорового человека это приводит к адекватному расширению коронарных сосудов и увеличению сократимости миокарда. В условиях лимитированного коронарного кровообращения у больных ишемической болезнью сердца увеличение потребности миокарда в кислороде приводит у острой коронарной недостаточности, сопровождающейся приступом стенокардии и изменениями на ЭКГ.
Существует несколько методов проведения пробы с физической нагрузкой, среди которых наибольшее распространение в клинической практике получили пробы с дозированной физической нагрузкой на велоэргометре или тредмиле (бегущая дорожка). Наиболее доступной является велоэргометрия. Используемый для этой цели велоэргометр (рис. 3.133) позволяет строго дозировать физическую нагрузку и оценивать величину выполненной внешней работы в ваттах (Вт) или килограммометрах (кГм). Для проведения пробы необходим также электрокардиограф (желательно многоканальный), сфигмоманометр для измерения уровня АД и фонендоскоп. Кабинет функциональной диагностики, где проводится исследование, должен быть оснащен дефибриллятором и набором средств для оказания неотложной помощи.
Велоэргометрическую пробу проводят обычно в первой половине дня натощак или через 2–3 ч после еды. Желательно, чтобы за сутки до проведения исследования пациент не принимал лекарственных препаратов, оказывающих влияние на результаты пробы с физической нагрузкой: нитратов пролонгированного действия, блокаторов β-адренорецепторов, антагонистов кальция, ингибиторов АПФ, сердечных гликозидов, мочегонных средств, некоторых противоаритмических препаратов.
ЭКГ регистрируют в 12 общепринятых отведениях (рис. 3.134). Для удобства проведения исследования электроды от верхних конечностей помещают на грудную клетку в подключичных областях или ниже углов лопаток, а электроды от нижних конечностей — в области поясницы.
Применяются различные схемы проведения велоэргометрической пробы (рис. 3.135). Чаще всего нагрузку повышают ступенеобразно каждые 3 мин, начиная с мощности 25 или 50 Вт (150–300 кГм/мин). Такое ступенеобразное повышение величины нагрузки на 25 Вт можно осуществлять как непрерывно в течение 15–18 мин, так и с 3-минутными перерывами для отдыха после каждой ступени нагрузки (у менее тренированных лиц или больных с тяжелыми заболеваниями сердца и резко сниженной толерантностью к физической нагрузке). Наиболее физиологичной считается непрерывная ступенеобразно возрастающая нагрузка (рис. 3.135, в, г).
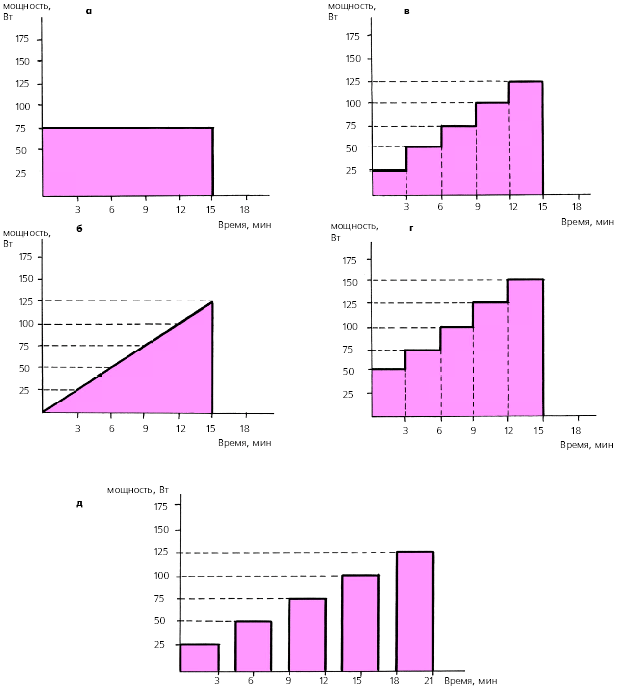
|
| Рис. 3.135. Различные схемы проведения велоэргометрической пробы. а - нагрузка постоянной мощности, б - быстро возрастающая нагрузка, в, г - непрерывная ступенеобразно возрастающая нагрузка (с различным исходным уровнем мощности), д - прерывистая ступенеобразно возрастающая нагрузка |
Велоэргометрическую пробу проводят под постоянным контролем ЭКГ на экране осциллоскопа, уровня АД и состояния больного. Запись ЭКГ и измерение АД проводят до начала исследования, в конце каждой минуты пробы, а также на 30-й секунде, 1-й, 2-й, 3-й, 5-й, 7-й и 10-й минутах отдыха. При необходимости регистрация ЭКГ в период отдыха может быть продолжена.
Тредмил представляет собой движущуюся дорожку, которая может устанавливаться под различным углом наклона. Скорость движения дорожки и угол ее наклона регулируется в зависимости от задаваемой мощности нагрузки и протокола исследования (табл. 3.8).
Таблица 3.8
Изменение скорости и угла подъема движущейся дорожки (протокол R. Bruce)
| Ступень нагрузки | Скорость | Угол подъема (в %) | Длительность нагрузки (мин) | |
| миль/ч | км/ч | |||
| 1,7 | 2,7 | |||
| 2,5 | 4,0 | |||
| 3,4 | 5,5 | |||
| 4,2 | 6,8 |
Примечание: Угол подъема дорожки принято оценивать в процентах: например, подъем конца дорожки на 5 см соответствует углу подъема 5% (2,5о) и т. д.
Пациент, находящийся на движущейся дорожке, шагает или бежит по ней (рис. 3.136). Развиваемая при этом мощность и величина выполненной работы оцениваются по таблицам или автоматически.
Контроль за динамикой ЭКГ, АД и ЧСС осуществляется таким же способом, как и при проведении велоэргометрической пробы.
Противопоказаниями против проведения велоэргометрии и тредмил-теста являются:
1. Острый ИМ (или подозрение на ИМ).
2. Нестабильная стенокардия (НС).
3. Сердечная недостаточность II–III стадии.
4. Дыхательная недостаточность II–III степени.
5. Острое нарушение мозгового кровообращения или хроническая дисциркуляторная недостаточность II-III степени.
6. Острые инфекционные заболевания, сопровождающиеся лихорадкой.
7. Острый тромбофлебит.
Существуют также относительные противопоказания:
1. Выраженная артериальная гипертензия (АД выше 200/100 мм рт. ст.).
2. Тяжелые нарушения ритма и проводимости (АВ-блокада II–III степени, мерцательная аритмия, пароксизмальные тахикардии).
3. Тахикардия неясного генез (ЧСС выше 100 уд. в мин).
4. Стеноз устья аорты (клапанный, подклапанный).
5. Аневризмы сердца и сосудов.
6. Частые синкопальные состояния в анамнезе.
7. Неврологические и психические заболевания.
8. Заболевания опорно-двигательного аппарата и др.
Следует отметить, что решение вопроса о возможности проведения велоэргометрической пробы должно быть строго индивидуальным и учитывать общее состояние больного, его гемодинамические показатели, целесообразность исследования, а также условия его проведения. Например, в настоящее время в некоторых специализированных кардиологических стационарах допускается проведение нагрузочных проб у больных инфарктом миокарда с целью ранней физической реабилитации этих больных (обычно начиная со 2-й недели заболевания). В ряде случаев велоэргометрические тесты могут проводиться у больных нестабильной стенокардией с целью уточнения диагноза и прогноза заболевания и т. п. Подобные исследования у больных ИМ и НС могут осуществляться только в специально оснащенных блоках интенсивной терапии или кардиореанимационных отделениях при участии врачей-реаниматологов.
Интерпретация результатов
При проведении пробы с дозированной физической нагрузкой у больных ИБС врач преследует обычно две основные цели: 1) определение толерантности пациента к физической нагрузке; 2) выявление клинических и электрокардиографических признаков ишемии миокарда, обусловленной коронарной недостаточностью, с целью диагностики ишемической болезни сердца.
Толерантность к нагрузке оценивают преимущественно по показателю максимальной (пороговой) мощности работы, выполненной пациентом. Используют и другие показатели: общий объем выполненной работы, длительность нагрузки, время возникновения боли в области сердца и депрессии сегмента RS-T и другие. Различают: 1) высокую толерантность, когда максимальная мощность нагрузки в момент ее прекращения равна 150 Вт (900 кГм/мин) и выше; 2) среднюю толерантность, когда максимальная мощность нагрузки равна 100–125 Вт (600–750 кГм/мин); 3) низкую толерантность, когда максимальная мощность нагрузки не превышает 25–75 Вт (150–450 кГм/мин).
Индивидуальная толерантность к физической нагрузке зависит от многих факторов, в том числе от величины коронарного резерва, т. е. индивидуальной способности к адекватному увеличению коронарного кровотока при физической нагрузке, от сократительной способности миокарда, физической тренированности обследуемого, от индивидуальной реакции сердечно-сосудистой системы на нагрузку в виде подъема или снижения артериального давления и т. д.
Таблица 3.9
Максимальная частота сердечных сокращений
в зависимости от пола и возраста
| Пол | Возраст в годах | ||||
| 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | |
| Мужчины | |||||
| Женщины |
Таблица 3.10
Субмаксимальная частота сердечных сокращений
(75% от максимальной) в зависимости от пола и возраста
| Пол | Возраст в годах | ||||
| 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | |
| Мужчины | |||||
| Женщины |
Критериями прекращения велоэргометрической пробыявляются:
1. Достижение пациентом максимальной или субмаксимальной возрастной ЧСС (см. табл. 3.9 и 3.10).
2. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения ( j ) (рис. 3.137 а, б).
3. Медленное косовосходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 в)
4. Подъем сегмента RS-T на 1,0 мм и более от исходного уровня на протяжении 80 мс от точки соединения (рис. 3.137 д, е).
5. Приступ стенокардии.
6. Снижение систолического АД (САД) на 20 мм рт. ст.
7. Подъем САД более 220 мм рт. ст. и/или диастолического АД (ДАД) более 110 мм рт. ст. м выше.
8. Возникновение приступа удушья или выраженной одышки.
9. Появление угрожающих нарушений ритма (частая ЖЭ, политопная ЖЭ, залповая ЖЭ, пароксизм суправентрикулярной или желудочковой тахикардии, пароксизм мерцательной аритмии) .
10. Возникновение АВ-блокады или блокады ножек пучка Гиса.
11. Изменение комплекса QRS: углубление и увеличение продолжительности ранее существовавших зубцов Q, переход патологического зубца Q в комплекс QS.
12. Появление резкой общей слабости.
13. Возникновение выраженного головокружения, головной боли, тошноты, нарушений координации движений.
14. Отказ больного от дальнейшего исследования.
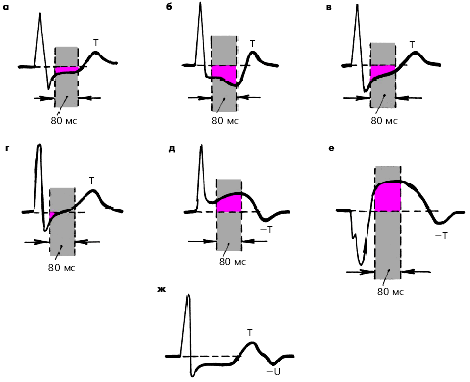
|
| Рис. 3.137. Различные виды ишемического и неишемического смещения сегмента RS-T при проведении проб с физической нагрузкой (схема). а - горизонтальное снижение (депрессия) сегмента RS-T, б - косонисходящее снижение, в - медленное косовосходящее снижение, г - быстрое косовосходящее снижение, д, е - ишемический подъем сегмента RS-T, ж - горизонтальное (ишемическое) снижение сегмента RS-T в сочетании с отрицательным зубцом U |
Следует подчеркнуть, что изменения зубца Т, нередко возникающие при выполнении физической нагрузки, не являются критериями прекращения нагрузочной пробы.
В табл. 3.9. приведены величины максимальной частоты сердечных сокращений в зависимости от пола и возраста, по достижении которой следует прекратить пробу с нагрузкой у здоровых людей. У больных с установленным диагнозом ишемической болезни сердца часто ограничиваются достижением так называемой субмаксимальнной частоты сердечных сокращений, составляющей 75% или 80% от максимальной, так как дальнейшее увеличение нагрузки опасно из-за возможности возникновения осложнений. В табл. 3.10 приведены величины субмаксимальной (75% от максимальной) ЧСС в зависимости от пола и возраста.
Важно помнить, что снижение толерантности к физической нагрузке возможно не только у больных ишемической болезнью сердца, но и у пациентов с другими органическими и функциональными заболеваниями сердечно-сосудистой системы и даже у малотренированных здоровых людей. Иными словами, снижение толерантности не является специфичным признаком наличия ишемической болезни сердца.
Диагностика преходящей ишемии миокарда, индуцированной нагрузочным тестом.При проведении функциональных нагрузочных тестов с целью объективного подтверждения ишемии миокарда могут быть получены следующие результаты (Д. М. Аронов с соавт., 1995):
1. положительная проба;
2. отрицательная проба;
3. сомнительная проба;
4. неинформативная (незавершенная) проба.
Положительная проба. Наиболее достоверными объективными диагностическими критериями ишемии миокарда являются следующие 3 электрокардиографических признака:
1. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 а, б).
2. Медленное косовосходящее снижение (депрессия) сегмента RS-T на 1,0 мм и более от исходного уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс от точки соединения (j) (рис. 3.137 в).
3. Подъем сегмента RS-T на 1,0 мм и более от исходного уровня на протяжении 80 мс от точки соединения (рис. 3.137 д, е).
Ишемические смещения сегмента RS-T ниже изоэлектрической линии связывают обычно с развитием субэндокардиальной ишемии миокарда. Ишемический подъем сегмента RS-T может свидетельствовать о трансмуральной ишемии миокарда, распространяющейся на все слои стенки ЛЖ, включая и субэпикардиальные ее отделы (рис. 3.138). Подъем сегмента RS-T может развиться, например, при спазме КА, индуцированном физической нагрузкой, а также при выраженном стенозировании КА или хронической аневризме ЛЖ, сопровождающихся критическим снижением коронарного кровотока. В этих последних случаях подъем сегмента RS-T часто сочетается с признаками нарушения сегментарной сократимости ЛЖ (дискинезия, акинезия или гипокинезия отдельных сегментов).
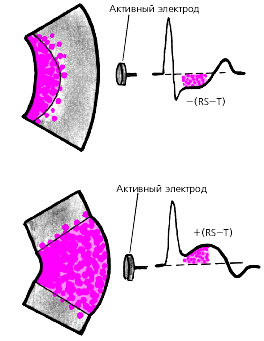
|
| Рис. 3.138. Связь различных видов смещения сегмента RS-T с локализацией ишемии миокарда, индуцированной физической нагрузкой а - субэндокардиальная, б - трансмуральная ишемия |
Отрицательная проба диагностируется в тех случаях, когда пациент при проведении исследования достиг заданной возрастной ЧСС, однако клинические и электрокардиографические признаки ишемии миокарда отсутствуют.
Сомнительная проба диагностируется в следующих случаях:
1. если в процессе исследования развился типичный для стенокардии или атипичный болевой синдром в грудной клетке, не сопровождающийся объективными ишемическими признаками на ЭКГ;
2. если наблюдается горизонтальное, косонисходящее или медленно восходящее смещение сегмента RS-T менее 1,0 мм от исходного уровня;
3. если во время исследования обнаружены нарушения ритма и проводимости (частая или политопная экстрасистолия, преходящие нарушения атриовентрикулярной или внутрижелудочковой проводимости, появление пароксизмов суправентрикулярной или желудочковой тахикардии);
4. если на высоте нагрузки произошло падение АД на 20 мм рт. ст. и более от исходного уровня.
Неинформативной (незавершенной) называют такую пробу, которая не была доведена до заданной возрастной ЧСС и не сопровождалась появлением описанных выше клинических или электрокардиографических признаков ишемии или дисфункции миокарда.
Следует подчеркнуть, что различные изменения морфологии зубца Т, в том числе отрицательные зубцы Т, нередко наблюдаются во время нагрузки у больных без поражения КА и даже у здоровых людей и не могут, таким образом, служить критерием ишемии.
Чувствительность проб с дозированной физической нагрузкой, проводимых с целью диагностики ишемической болезни сердца колеблется от 62% до 80%, специфичность — от 83% до 96% (Б. А. Сидоренко с соавт., 1996).
Ложноположительные результатыпробы с физической нагрузкой могут выявляться у 17% больных и здоровых лиц без поражения КА, причем у женщин частота ложноположительных результатов пробы значительно выше, чем у мужчин (Д. М. Аронов с соавт., 1995). Наиболее частыми причинами ложноположительных результатов пробы являются:
1. Нейроциркуляторная дистония (преимущественно нарушения симпатической иннервации, влияющие на процесс реполяризации).
2. Заболевания, сопровождающиеся выраженной гипертрофией миокарда ЛЖ.
3. Пролапс митрального клапана.
4. Заболевания и синдромы, сопровождающиеся значительными нарушениями электролитного баланса.
5. Синдромы CLC и WPW.
6. Блокады ножек пучка Гиса.
7. Анемии различного генеза (гипоксия миокарда).
8. Хронические заболевания легких, сопровождающиеся выраженной дыхательной недостаточностью (гипоксия миокарда).
9. Прием некоторых лекарственных препаратов (сердечных гликозидов, мочегонных, эстрогенов и др.).
Частота ложноотрицательных результатов пробы с дозированной физической нагрузкой у больных ИБС достигает 20-38%.
На рис. 3.139 представлена ЭКГ, зарегистрированная у больного ИБС с типичной положительной велоэргометрической пробой.
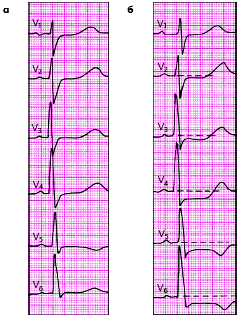
|
| Рис. 3.139. Изменения ЭКГ в грудных отведениях во время велоэргометрической пробы у больного ишемической болезнью сердца (положительная проба). а - исходная ЭКГ (в покое), б - ЭКГ, зарегистрированная на высоте нагрузки (смещение сегмента RS-T ниже изоэлектрической линии горизонтального типа) |
Дипиридамоловый тест
Проба с дипиридамолом (курантилом) применяется с целью выявления коронарной недостаточности, особенно в тех случаях, когда по разным причинам невозможно проведение пробы с дозированной физической нагрузкой.
Внутривенное относительно быстрое введение больших доз дипиридамола, являющегося мощным вазодилататором, приводит к значительному расширению артериол в зонах непораженных коронарных артерий, тогда как артериолы в бассейне стенозированных коронарных сосудов расширяются в значительно меньшей степени. Это приводит к патологическому перераспределению крови в различных участках сердечной мышцы: усиливается кровоснабжение интактных участков миокарда и уменьшается коронарный кровоток по стенозированным коронарным артериям (феномен «межкоронарного обкрадывания»). В результате возникают участки ишемии сердечной мышцы, локализация которых в целом хорошо соответствует бассейнам кровоснабжения пораженных коронарных сосудов.
Перед проведением теста следует отменить прием лекарственных препаратов и пищевых продуктов, содержащих ксантиновые производные (эуфиллин, теофиллин, кофе, крепкий чай и т. п.). Дипиридамол вводят внутривенно в дозе 0,75 мг на 1 кг массы тела, что составляет обычно 10–12 мл 0,5% раствора. Чаще всего расчетную дозу препарата делят на 3 равные части, которые вводят в 3 этапа. В течение первых трех минут вводят первую треть дозы, затем в течение следующих 3–5 мин—вторую треть. Если к этому времени не появятся клинические или/и электрокардиографические признаки ишемии миокарда, на протяжении следующих 3–5 мин вводят последнюю треть дозы.
Дипиридамоловую пробу осуществляют под постоянным ЭКГ-контролем. При отсутствии признаков ишемии миокарда ЭКГ регистрируют еще 10, 15 и 20 мин после окончания введения препарата. Исследование завершают внутривенным введением 10 мл 2,4% раствора эуфиллина, который является физиологическим антагонистом дипиридамола.
Критерии положительного дипиридамолового теста те же, что и при проведении пробы с дозированной физической нагрузкой: ишемическая депрессия или элевация сегмента RS-T на 1,0 мм и больше от исходного уровня. Введение дипиридамола может сопровождаться небольшой тахикардией, снижением АД, головной болью, тяжестью в нижних конечностях.
Чувствительность дипиридамолового теста составляет 60–75%, специфичность – 70–90%.
Проба с изопротеренолом
Изопротеренол (изадрин, изупрел) обладает, как известно, выраженным b-адреностимулирующим действием. При введении препарата увеличивается ЧСС, повышается АД, значительно увеличивается работа сердца и, соответственно, потребность миокарда в кислороде. В условиях лимитированного коронарного кровоснабжения это приводит к возникновению преходящей ишемии миокарда.
Изопротеренол в дозе 0,5 мг вводят внутривенно капельно в 200 мл изотонического раствора натрия хлорида. В течение первой минуты препарат вводят со скоростью 10—20 капель в мин. В течение последующих 2–3 мин скорость введения изопротеренола повышают, доводя ЧСС до 130–150 в мин, после чего введение препарата прекращают.
Для диагностики преходящей ишемии миокарда используют те же критерии, что и при проведении проб с дозированной физической нагрузкой и дипиридамолового теста. Чувствительность пробы с изопротеренолом составляет 60–70%, специфичность — 70–90%. Проба используется в основном для диагностики ИБС у больных, у которых выполнение интенсивной физической нагрузки по разным причинам невозможно.
Проба с эргометрином
Проба с эргометрином, являющегося стимулятором a-адренорецепторов, используется в основном для подтверждения спастического механизма коронарной недостаточности, в частности, у больных ИБС, у которых во время коронароангиографии не обнаруживается стенозирование КА, а клиническая картина заставляет заподозрить вазоспастическую форму стенокардии (стенокардия Принцметала). Проба с эргометрином опасна развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии), в связи с чем она используется для диагностики ИБС только в специализированных научно-исследовательских учреждениях (Д. М. Аронов с соавт., 1996).
Использование длительного мониторирования ЭКГ по Холтеру и чреспищеводной электростимуляции сердца для диагностики ишемической болезни сердца описано ниже
Электрокардиограмма при остром инфаркте миокарда
Крупноочаговый инфаркт миокарда (ИМ) развивается при остром нарушении коронарного кровообращения, обусловленном тромбозом или (реже) выраженным и длительным спазмом коронарной артерии. Согласно представлениям Bayley, такое нарушение кровообращения в сердечной мышце приводит к формированию трех зон патологических изменений: вокруг участка некроза располагаются зоны ишемического повреждения и ишемии (рис. 3.119). Поэтому на ЭКГ, зарегистрированной при остром крупноочаговом инфаркте миокарда, фиксируются не только патологический зубец Q или комплекс QS (некроз), но и смещение сегмента RS-T выше или ниже изолинии (ишемическое повреждение), а также остроконечные и симметричные коронарные зубцы Т (ишемия).
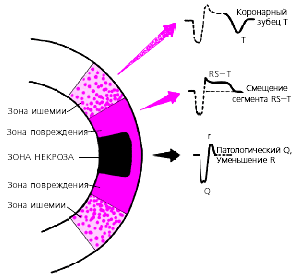
|
| Рис. 3.119. Три зоны патологических изменений в сердечной мышце при остром инфаркте миокарда (по Bayley) и их отражение на ЭКГ (схема) |
ЭКГ изменяется в зависимости от времени, прошедшего от начала формирования инфаркта миокарда, в течении которого различают: 1) острую стадию — от нескольких часов до 14–16 суток от начала ангинозного приступа; 2) подострую стадию, длящуюся примерно от 15–20 суток от начала инфаркта до 1,5–2 месяцев; 3) рубцовую стадию.
Динамика ЭКГ в зависимости от стадии инфаркта представлена на рис. 3.120. Острая стадия характеризуется быстрым, в течение 1–2 суток, формированием патологического зубца Q или комплекса QS, смещением сегмента RS-T выше изолинии и сливающегося с ним вначале положительного, а затем отрицательного, зубца Т. Через несколько дней сегмент RS-T несколько приближается к изолинии. На 2–3й неделе заболевания сегмент RS-T становится изоэлектричным, а отрицательный коронарный зубец Т резко углубляется и становится симметричным, заостренным (повторная инверсия зубца Т).
В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20–25–х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS-T расположен на изолинии.
Рубцовая стадия ИМ характеризуется сохранением в течение ряда лет, нередко в течение всей жизни больного, патологического зубца Q или комплекса QS и наличием слабоотрицательного, сглаженного или положительного зубца Т.
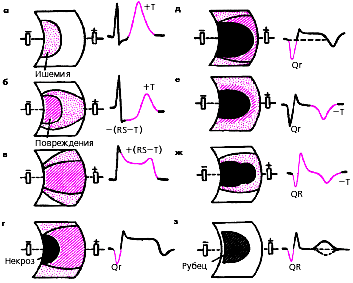
|
| Рис. 3.120. Динамика изменений ЭКГ в острой (а - е), подострой (ж) и рубцовой (з) стадиях инфаркта миокарда. Объяснения в тексте |
Изменения ЭКГ при острых инфарктах миокарда различной локализации представлены в табл. 3.7. Прямыми признаками острой стадии инфаркта являются патологический зубец Q (или комплекс QS), элевация (подъем) сегмента RS-T и отрицательный (коронарный) зубец Т. В «противоположных» отведениях нередко встречаются так называемые реципрокные изменения ЭКГ: депрессия сегмента RS-T ниже изолинии и положительный остроконечный и симметричный (коронарный) зубец Т. Иногда наблюдается некоторое увеличение амплитуды зубца R.
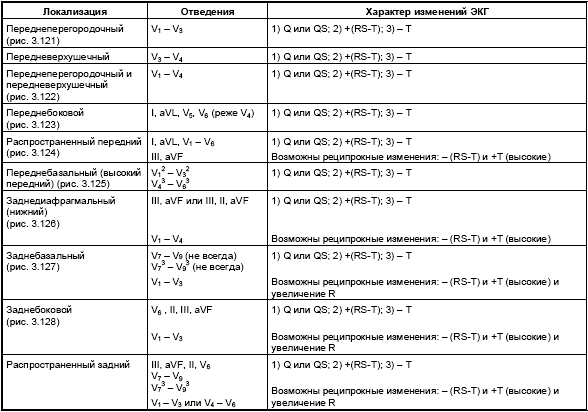
|
На рис. 3.121–3.128 приведены ЭКГ больных с острым ИМ различной локализации. Следует помнить, что трансмуральный ИМ той или иной локализации диагностируется в тех случаях, когда в двух или более отведениях, расположенных над областью инфаркта, регистрируется комплекс QS, а крупноочаговый инфаркт—при наличии патологического зубца Q.
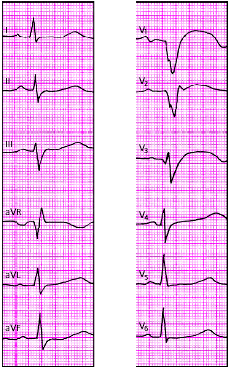
|
| Рис. 3.121. ЭКГ при переднеперегородочном инфаркте миокарда |
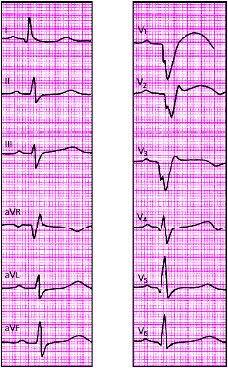
|
| Рис. 3.122. ЭКГ при переднеперегородочном инфаркте миокарда с переходом на верхушку |
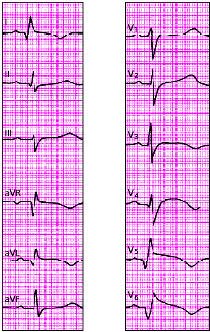
|
| Рис. 3.123. ЭКГ при переднебоковом инфаркте миокарда |
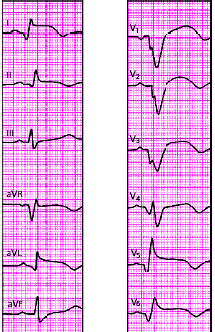
|
| Рис. 3.124. ЭКГ при распространенном переднем инфаркте миокарда |
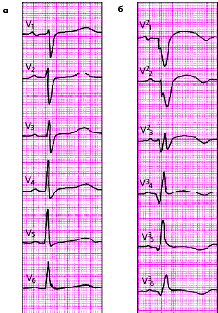
|
| Рис. 3.125. ЭКГ при переднем базальном (высоком переднем) инфаркте миокарда а - при обычном расположении грудных электродов (инфаркт не выявляется), б - при расположении электродов на 2 ребра выше (регистрируются типичные признаки инфаркта миокарда) |
|
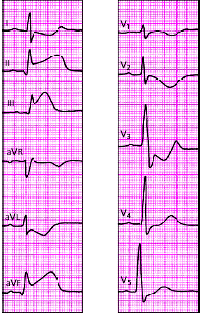
| Рис. 3.126. ЭКГ при остром заднедиафрагмальном (нижнем) инфаркте миокарда. В отведениях I, aVL, V1-V4 регистрируются реципрокные изменения ЭКГ |
|
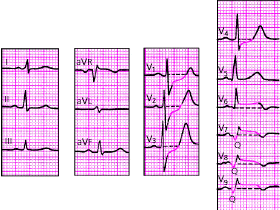
| Рис. 3.127. ЭКГ при заднебазальном инфаркте миокарда |
|
| Рис. 3.128. ЭКГ при заднебоковом инфаркте миокарда |
При постинфарктной аневризме (рис. 3.129) ЭКГ характеризуется обычно наличием комплекса QS и подъема сегмента RS-T выше изолинии в нескольких отведениях, причем ЭКГ не претерпевает изменений в зависимости от стадий инфаркта миокарда («застывшая» ЭКГ).
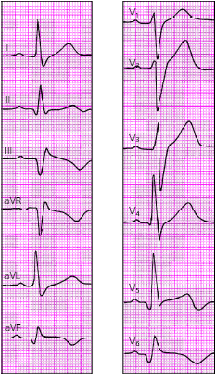
|
| Рис. 3.129. "Застывшая" ЭКГ при постинфарктной аневризме левого желудочка. Через 2 месяца после перенесенного переднего инфаркта миокарда в области аневризмы (межжелудочковая перегородка и верхушка) сохраняется подъем сегмента RS-T |
Наконец, электрокардиографическими признаками мелкоочагового ИМ («не-Q-инфаркта миокарда») являются смещение сегмента RS-T выше или ниже изолинии и/или разнообразные остро появившиеся патологические изменения зубца Т (чаще отрицательный коронарный зубец Т). Эти патологические изменения ЭКГ наблюдаются на протяжении 3–5 недель от начала инфаркта (рис. 3.130 и 3.131).
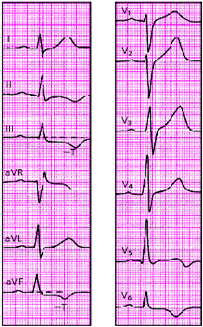
|
| Рис. 3.130. ЭКГ при остром мелкоочаговом инфаркте миокарда в области заднедиафрагмальной (нижней) стенки с переходом на боковую стенку левого желудочка |
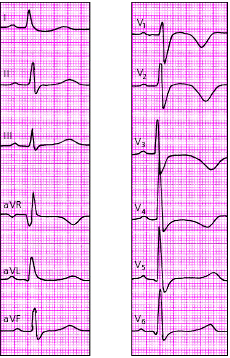
|
| Рис. 3.131. ЭКГ при остром мелкоочаговом инфаркте миокарда переднеперегородочной и верхушечной областей |
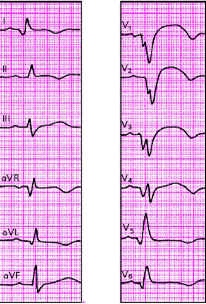
При субэндокардиальном ИМ комплекс QRS также может быть не изменен, патологический Q отсутствует (рис. 3.132). В первые сутки такого инфаркта появляется смещение сегмента RS-T ниже изолинии на 2–3 мм в двух и более отведениях, а также отрицательный зубец Т. Сегмент RS-T нормализуется обычно в течение 1–2 недель, а зубец Т остается отрицательным, проделывая ту же динамику, что и при крупноочаговом инфаркте.
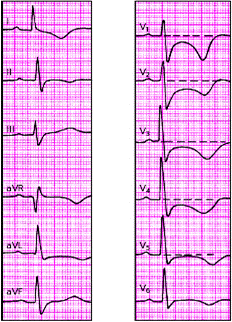
|
| Рис. 3.132. ЭКГ при субэндокардиальном инфаркте миокарда передней стенки левого желудочка |
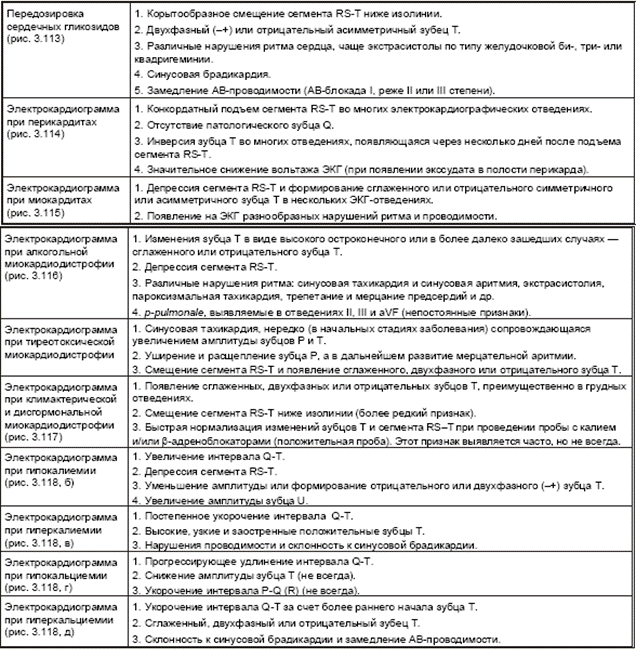
Электрокардиограмма при воспалительных, дистрофических и метаболических поражениях сердца и элктролитных нарушениях
В табл. 3.6. представлены электрокардиографические признаки воспалительных, дистрофических и метаболических поражений сердца, а также электролитных нарушений.
Таблица 3.6
Электрокардиографические признаки воспалительных, дистрофических и метаболических поражений сердца, а также элкетролитных нарушений
|
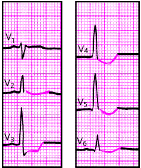
| Рис. 3.113 . ЭКГ при передозировке сердечных гликозидов |
|
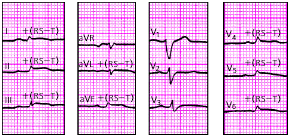
| Рис. 3.114. ЭКГ при перикардите |
|
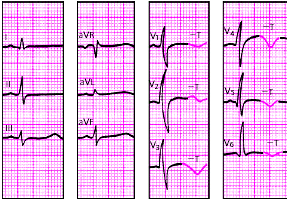
| Рис. 3.115. ЭКГ при миокардите |
|
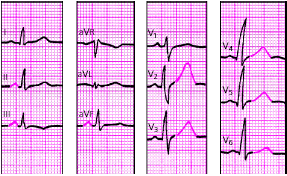
| Рис. 3.116. ЭКГ при алкогольной миокардиодистрофии |
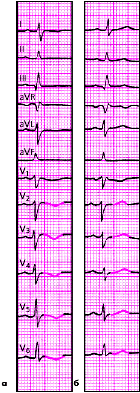
|
| Рис. 3.117. ЭКГ при дисгормональной миокардиодистрофии. а - исходная ЭКГ; б - ЭКГ после приема бета-адреноблокаторов (положительная проба) |
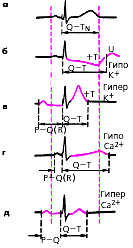
|
| Рис. 3.118. Схема изменений ЭКГ при нарушениях электролитного обмена. а - норма; б - гипокалиемия; в - гиперкалиемия; г - гипокальциемия; д - гиперкальциемия |
Дата добавления: 2016-04-22; просмотров: 2480;
