Электрокардиограмма 8 страница
В легких определяются ослабленное дыхание, мелкопузырчатые влажные хрипы или крепитация, что указывает на развитие инфарктной пневмонии или инфаркта легкого. Нередко при поражении плевры можно выслушать шум трения плевры.
При исследовании сердечно-сосудистой системы определяются тахикардия более 100 уд. в мин, акцент II тона на легочной артерии, отражающий развитие гипертензии малого круга кровообращения. Характерно также снижение АД. В части случаев определяется парадоксальный пульс (см. главу 12), отражающий возникновение острой правожелудочковой недостаточности (острого легочного сердца). При выраженной систолической дисфункции ПЖ и повышении ЦВД определяются набухание шейных вен, абдоминально-югулярный рефлюкс (см. главу 2).
При развитии острого легочного сердца в V межреберье по левому краю грудины выслушивается патологический III тон (правожелудочковый протодиастолический ритм галопа). При перкуссии сердца в этих случаях можно выявить смещение вправо правой границы относительной тупости и умеренное расширение абсолютной тупости сердца.
| 14.3.2. Немассивная ТЭЛА |

|
Тромбоэмболия мелких ветвей легочной артерии в большинстве случаев протекает с менее выраженными симптомами или бессимптомно и нередко остается нераспознанной. Часто немассивная ТЭЛА протекает “под маской” других заболеваний и синдромов (В.Б. Яковлев):
- повторных “пневмоний” неясной этиологии, часть которых протекает как плевропневмония;
- быстропроходящих (в течение 2–3 суток) сухих плевритов;
- экссудативных плевритов, в том числе геморрагических;
- повторных “необъяснимых” обмороков, коллапсов, нередко сопровождающихся ощущением нехватки воздуха и тахикардией;
- внезапно возникающего чувства сдавления в груди, затруднения дыхания и последующего повышения температуры тела;
- “беспричинной” лихорадки, не поддающейся антибактериальной терапии;
- появлением и/или прогрессированием сердечной недостаточности, резистентной к лечению;
- появлением и/или прогрессированием симптомов подострого или хронического легочного сердца при отсутствии указаний на хронические заболевания бронхолегочного аппарата.
Следует подчеркнуть, что нередко тяжесть клинической картины заболевания не соответствует объему тромбоэмболической окклюзии. Так, эмболия мелких ветвей легочной артерии может протекать с клинически хорошо очерченными проявлениями инфаркта легкого, интенсивными плевральными болями, признаками дыхательной недостаточности и артериальной гипотонии, тогда как отдельные случаи массивной ТЭЛА могут проявляться только умеренно выраженной одышкой и тахикардией.
Важной задачей клинического и инструментального исследования больных ТЭЛА является установление источника тромбоэмболии. В то же время отчетливые клинические признаки тромбоза глубоких вен нижних конечностей — наиболее частой причины ТЭЛА — обнаруживают только в  случаев. Следует помнить, что к числу ранних признаков флеботромбоза глубоких вен относятся:
случаев. Следует помнить, что к числу ранних признаков флеботромбоза глубоких вен относятся:
- спонтанные боли в области стопы и голени, усиливающиеся при ходьбе;
- появление боли в икроножных мышцах при тыльном сгибании стопы (симптом Хоманса);
- локальная болезненность при пальпации по ходу вен;
- односторонний отек голени, стопы и бедра, выявляемый при осмотре в горизонтальном и вертикальном положении пациента (рис. 14.4).
| Рис. 14.4. Измерение объема голени и бедра у больных с подозрением на тромбоз глубоких вен нижних конечностей | 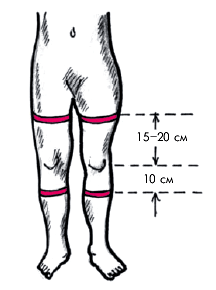
|
Более информативным является дуплексное ультразвуковое и допплеровское исследование глубоких вен, которое в большинстве случаев позволяет выявить признаки нарушения венозного кровообращения, локализацию и протяженность тромботической окклюзии.
| 14.4. Лабораторная и инструментальная диагностика |

|
К числу обязательных инструментальных исследований, которые проводятся у всех больных с ТЭЛА, относятся ЭКГ, исследование газов артериальной крови, рентгенография органов грудной клетки, эхокардиограмма, вентиляционно-перфузионная сцинтиграфия легких, ультразвуковое исследование магистральных вен нижних конечностей. Большинство из них, за исключением вентиляционно-перфузионной сцинтиграфии легких, используют не столько для подтверждения диагноза ТЭЛА, сколько для исключения других заболеваний, которые протекают со сходной клинической симптоматикой (ИМ, пневмонии, плевритов, хронических обструктивных заболеваний легких, пневмоторакса и др.).
К дополнительным методам исследования относятся ангиография и катетеризация правых отделов сердца.
| 14.4.1. Электрокардиография |

|
Электрокардиография применяется, в основном, для исключения острого ИМ, а также диагностики нарушений сердечного ритма, которые часто обнаруживают у больных с ТЭЛА: синусовой тахикардии, фибрилляции и трепетания предсердий, суправентрикулярной и желудочковой экстрасистолии и др. (подробнее см. главу 3).
Лишь в 20–25% случаев, как правило, при массивной ТЭЛА и развитии клинической картины острого легочного сердца, наблюдаются признаки острой перегрузки ПЖ. В этих случаях значительное преобладание электрической активности ПЖ и правой половины МЖП, ведущее к резкому изменению пространственного расположения моментных векторов деполяризации желудочков, напоминает соответствующие нарушения, выявляемые при гипертрофии ПЖ. Наибольшее значение имеют следующие ЭКГ-признаки острого легочного сердца, получившие название “синдрома McGinn — White” (рис. 14.5):
| Рис. 14.5. Электрокардиограмма при массивной тромбоэмболии легочной артерии и развитии острого легочного сердца. Объяснение в тексте | 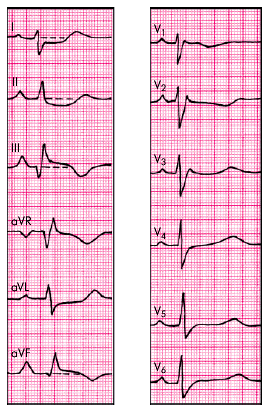
|
- внезапное углубление зубцов QIII и SI (признак QIIISI);
- подъем сегмента RS–T в отведениях III, aVF, V1 и V2 и дискордантное снижение сегмента RS–T в отведениях I, aVL, V5 и V6;
- появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
- полная или неполная блокада правой ножки пучка Гиса.
Характерна также быстрая положительная динамика указанных изменений при купировании тромбоэмболии и улучшении состояния больного.
Довольно часто при ТЭЛА и повышении давления в легочной артерии выявляются признаки острой электрической перегрузки правого предсердия в виде остроконечных высокоамплитудных зубцов Р в отведениях III, II и aVF (P-pulmonale). После эффективного лечения ТЭЛА и нормализации давления в легочной артерии эти признаки быстро уменьшаются и исчезают.
Следует помнить, что примерно в 20–30% случаев, преимущественно при тромбоэмболии мелких ветвей легочной артерии, на ЭКГ вообще могут отсутствовать какие-либо патологические изменения.
| 14.4.2. Рентгенография органов грудной клетки |

|
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме малоспецифичных рентгенологических признаков:
- высокое стояние купола диафрагмы на стороне поражения;
- инфильтрация легочной ткани (спустя 12–36 ч от начала заболевания);
- выбухание конуса легочной артерии;
- увеличение правых отделов сердца;
- расширение верхней полой вены и др.
Эти признаки лишь с определенной степенью вероятности могут быть ассоциированы с возникновением ТЭЛА, причем только в тех случаях, когда они сочетаются с описанными клиническими симптомами эмболии (внезапно наступающей одышкой, болями в грудной клетке и т.д.).
| Рис. 14.6. Рентгенограмма легких в прямой проекции при инфаркте легкого (наблюдение Л.С. Розенштрауха с соавт.) | 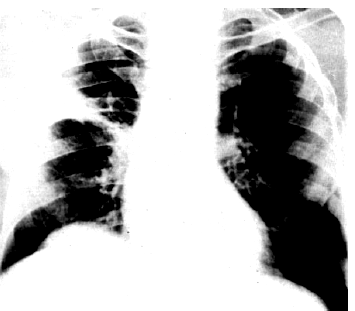
|
Более специфичным, но относительно редким признаком ТЭЛА является симптом Вестермарка — обеднение легочного рисунка в области поражения, что свидетельствует о массивной эмболии легочной артерии. Этот рентгенологический признак встречается не более чем у 5% больных ТЭЛА. Довольно редко на рентгенограммах можно обнаружить классические признаки инфаркта легкого — треугольную тень в легочном поле, основанием обращенную к плевре (рис. 14.6).
Следует подчеркнуть, что отсутствие изменений на рентгенограмме грудной клетки не исключает диагноза ТЭЛА.
| 14.4.3. Ультразвуковое исследование |

|
Эхокардиография у больных с ТЭЛА позволяет выявить объективные признаки острого легочного сердца и повышения давления в легочной артерии, оценить гемодинамические нарушения, а также исключить патологию клапанного аппарата. Методика исследования этих параметров была подробно описана в предыдущих главах руководства.
Ультразвуковое допплеровское исследование глубоких вен нижних конечностей дает возможность объективно подтвердить наличие тромбоза вен и получить важную информацию о его локализации и распространенности. Эти данные необходимы для выбора оптимальной тактики последующего лечения (в том числе хирургического) больных, перенесших ТЭЛА. Наиболее точные данные могут быть получены при использовании дуплексного сканирования вен.
| 14.4.4. Вентиляционно-перфузионная сцинтиграфия легких |

|
Ведущее место в диагностике ТЭЛА занимает вентиляционно-перфузионная сцинтиграфия легких, которая представляет собой сочетание радионуклидного исследования региональных нарушений легочной вентиляции (пневмосцинтиграфии) и перфузии (пульмоносцинтиграфии). В табл. 14.2 приведены основные характеристики этих двух методов исследования.
Наибольшее значение имеет методика перфузионной пульмоносцинтиграфии с внутривенным введением микросфер альбумина, меченных 99mTc. Поскольку диаметр этих частиц не превышает 10–30 мкм, они хорошо распределяются в кровотоке и скапливаются в легочных артериолах, причем незначительная часть артериол (не более 0,1%) эмболизируется. Изображение получают с помощью гамма-камеры в шести стандартных позициях. Метод перфузионной сцинтиграфии дает возможность изучить региональную легочную гемодинамику, что может быть использовано для диагностики ТЭЛА. Он отличается высокой чувствительностью, но недостаточно специфичен, поскольку многие патологические процессы в легких сопровождаются региональным снижением перфузии (опухоли легкого, пневмонии, обструктивные заболевания легких, пневмосклероз и т.д.).
Таблица 14.2
Основные характеристики перфузионной и вентиляционной сцинтиграфии
| Методы | Изотоп | Т1/2 | Способвведения | Возможностидиагностики |
| Перфузионная пульмоносцинтиграфия | 99mTc 133Xe | 6 ч 5 суток | Внутривенное введение | Изучение региональной легочной перфузии |
| Вентиляционная пневмосцинтиграфия | 81Kr 133Xe | 13 c 5 суток | Вдыхание газовой смеси | Изучение региональной воздушной вентиляции |
Более достоверные результаты могут быть получены при одновременном использовании различных модификаций вентиляционного сканирования легких (пневмосцинтиграфии). Для этой цели предпочтительно применение ингаляций воздушно-газовой смеси, содержащей 81Kr с очень коротким периодом полураспада (13 с). Другие радиоактивные изотопы (133Xe и 99mTc), будучи введенными ингаляционно в виде газов (ксенон) или жидких аэрозолей (технеций), также могут использоваться для оценки региональной вентиляции. Однако более продолжительный период их полураспада требует значительного интервала времени между проведением перфузионного и вентиляционного сканирования легких.
Диагноз ТЭЛА наиболее вероятен, если при применении вентиляционного и перфузионного сканирования в двух и более сегментах легкого обнаруживается выраженное несоответствие между значительно сниженной перфузией и нормальной или мало измененной вентиляцией (рис. 14.7), а на обычной рентгенограмме в этой области не удается выявить признаков других патологических процессов, сопровождающихся локальным уменьшением кровотока (опухоль, абсцесс, полость и т.п.). В этих случаях вероятность тромбоэмболии ветвей легочной артерии достигает 90% [J. Rees].
В противоположность этому, если происходит одновременное снижение перфузии и вентиляции, а на рентгенограмме в этой зоне отсутствуют значительные изменения или, наоборот, выявляется обширное поражение, диагноз тромбоэмболии весьма сомнителен.
 Запомните
Наиболее достоверный признак ТЭЛА, выявляемый при анализе перфузионных и вентиляционных сканограмм, — это наличие выраженного локального снижения перфузии участка легкого при отсутствии здесь сколько-нибудь значительных вентиляционных расстройств и изменений на обычной рентгенограмме. Признак отличается высокой диагностической точностью, достигающей 90%. Отсутствие изменений на перфузионной и вентиляционной сканограммах практически полностью исключает диагноз ТЭЛА. Запомните
Наиболее достоверный признак ТЭЛА, выявляемый при анализе перфузионных и вентиляционных сканограмм, — это наличие выраженного локального снижения перфузии участка легкого при отсутствии здесь сколько-нибудь значительных вентиляционных расстройств и изменений на обычной рентгенограмме. Признак отличается высокой диагностической точностью, достигающей 90%. Отсутствие изменений на перфузионной и вентиляционной сканограммах практически полностью исключает диагноз ТЭЛА.
|
| Рис. 14.7. Перфузионная (а) и вентиляционная (б) сцинтиграммы при тромбоэмболии легочной артерии. Объяснение в тесте | 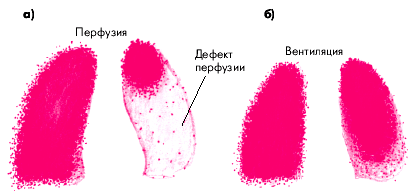
|
Если тромбоэмболия осложняется развитием инфаркта легкого, вместе со снижением перфузии, как правило, происходит локальное уменьшение вентиляции, а на рентгенограмме появляются признаки уплотнения легочной ткани.
| 14.4.5. Ангиопульмонография |

|
Ангиография сосудов легких (селективная ангиопульмонография) является эталонным методом диагностики ТЭЛА. Информативность этого метода приближается к 100%, в том числе при эмболии мелких ветвей легочной артерии.
Селективная ангиопульмонография — это рентгенологический метод исследования сосудов легких и легочного кровотока, при котором контрастное вещество (уротраст, верографин, урографин и др.) вводится с помощью катетеров непосредственно в сосудистое русло. Для введения рентгеноконтрастного вещества в ствол легочной артерии, левую, правую или концевые (терминальные) ветви легочной артерии производят чрескожную катетеризацию бедренной вены по Сельдингеру и проводят катетер через правое предсердие и правый желудочек в легочную артерию и ее ветви. Для контрастирования бронхиальных или добавочных артерий большого круга кровообращения применяют ретроградную катетеризацию бедренной артерии. Методика и техника венозной и артериальной катетеризации подробно описаны в главах 4 и 6.
Таким образом, селективная ангиопульмонография дает возможность получить максимальную информацию об анатомическом и функциональном состоянии сосудов легких. Наиболее общими показаниями для использования этого метода являются:
1. Тромбоэмболия ветвей легочной артерии, особенно в тех случаях, когда другие методы исследования (например, радионуклидные) дают сомнительные результаты, а антикоагулянтная или тромболитическая терапия чревата повышенным риском кровотечений (J. Rees).
2. Рецидивирующее кровохарканье или легочное кровотечение, генез которых не удается выяснить с помощью обычных методов клинико-инструментального исследования больного.
3. Подозрение на врожденную аномалию легкого или легочных сосудов, когда от точности установления диагноза зависит выбор наиболее рационального метода лечения, включая оперативное вмешательство.
4. Уточнение риска предстоящей операции при точно установленном диагнозе.
Ангиография противопоказана при тяжелом общем состоянии больного, выраженной сердечно-легочной недостаточности с признаками легочной гипертензии, при нарушениях ритма сердца, выраженной печеночно-почечной недостаточности, тромбофлебите или флеботромбозе нижних конечностей, непереносимости препаратов йода.
Исследование выполняется в специально оборудованной операционной, оснащенной рентгенотелевизионной установкой, видеомагнитофоном и скоростной кинокамерой. После катетеризации соответствующих сосудов и селективного введения рентгеноконтрастного вещества получают серию ангиограмм, отражающих динамику заполнения контрастным веществом сосудистого русла в артериальной, капиллярной и венозной фазах кровотока. Оценивают сужение, деформацию, характер ветвлений сегментарных и субсегментарных артерий, наличие артериальной обструкции, “культи” артерии, отсутствие контрастирования определенных зон легкого, а также скорость артериального кровотока, характер возможного перераспределения кровотока и другие признаки.
Наиболее характерными ангиографическими признаками ТЭЛА являются:
- полная обтурация одной из ветвей легочной артерии и формирование “культи” одной из крупных ее ветвей (рис. 14.8);
- резкое локальное обеднение сосудистого рисунка, соответствующее бассейну эмболизированной артерии;
- внутриартериальные дефекты наполнения;
- расширение обтурированной ветви легочной артерии проксимальнее места обструкции.
| Рис. 14.8. Схема ангиограммы легких при тромбоэмболии ветви легочной артерии (а). Стрелкой показан артериальный дефект наполнения в области локализации эмбола и обрыв наполнения артерии («культя» артерии). б — нормальная ангиограмма (схема) | 
|
Следует помнить, что локальное отсутствие контрастирования дистальных разветвлений легочной артерии (зоны аваскуляризации) и формирование “культи” артерии встречается не только при ТЭЛА, но и при других патологических состояниях (рак легкого, абсцесс, крупная воздушная полость и т.п.). В этих случаях для установления правильного диагноза необходимо учитывать данные других методов исследования (рентгенологического, пульмоносцинтиграфии и т.п.) в сопоставлении с клинической картиной заболевания.
Таким образом, селективная ангиопульмонография позволяет получить наиболее полное представление об изменениях сосудистого русла легких при ТЭЛА.
| 14.5. Лечение |

|
В зависимости от объема эмболического поражения сосудистого русла легких и выраженности гемодинамических нарушений используют несколько методов лечения больных ТЭЛА:
- антикоагулянтную и антитромбоцитарную терапию;
- тромболитическую терапию;
- хирургическое лечение.
| 14.5.1. Антикоагулянтная и антитромботическая терапия |

|
Антикоагулянтная и антитромботическая медикаментозная терапия служит основным методом лечения больных ТЭЛА. Ее целью являются предотвращение продолжающегося вторичного тромбозирования и увеличения объема поражения, а также профилактика повторных тромбозов глубоких вен нижних конечностей и тромбоэмболии. С этой целью используют нефракционированный и низкомолекулярные (фракционированные) гепарины, методика применения которых была подробно описана в главе 6, а также непрямые антикоагулянты и антиагреганты.
Гепарины. При ТЭЛА наиболее целесообразна следующая схема введения нефракционированного гепарина. Вначале внутривенно струйно (болюсом) вводят 5–10 тыс. МЕ гепарина, а затем продолжают внутривенное капельное введение препарата со скоростью 1000 МЕ в час. Суточная доза гепарина не превышает 30 000 МЕ. В.Б. Яковлев, Л.И. Ольбинская и др. рекомендуют в качестве альтернативной схемы длительного введения гепарина прерывистое внутривенное или подкожное введение гепарина по 5000 МЕ каждые 4 ч. Общая продолжительность гепаринотерапии должна быть не меньше 7–10 дней, поскольку именно в эти сроки происходит лизис и/или организация тромба.
Гепаринотерапия проводится при обязательном контроле активированного частичного тромбопластинового времени (АЧТВ), которое определяют каждые 4 ч, пока, по крайней мере, дважды не будет обнаружено увеличение АЧТВ в 1,5–2 раза выше исходного уровня, после чего АЧТВ определяют 1 раз в сутки. Если АЧТВ увеличивается менее чем в 1,5 раза выше исходного, внутривенно струйно вводят 2–5 тыс. МЕ гепарина и увеличивают скорость инфузии на 25%. Если АЧТВ более чем в 3 раза превышает исходный показатель, скорость инфузии уменьшают на 25%. Противопоказания и побочные эффекты гепарина подробно изложены в главе 6.
В последние годы для лечения больных ТЭЛА успешно используются низкомолекулярные гепарины (фраксипарин, эноксапарин, надропарин, дельтапарин и др.), которые отличаются более высокой эффективностью и вместе с тем более редким возникновением нежелательных побочных явлений, в том числе геморрагических осложнений и тромбоцитопений. Следует помнить, что низкомолекулярные гепарины относительно мало влияют на тромбин и почти не связывают II фактор коагуляции. Поэтому на фоне лечения низкомолекулярными гепаринами мало изменяется время свертывания крови, хотя и наблюдается отчетливый терапевтический эффект, в частности, уменьшение адгезии и агрегации тромбоцитов.
Дозируют низкомолекулярные гепарины индивидуально от 0,3 до 0,8 мг 2 раза в сутки. Считают, что при лечении низкомолекулярными гепаринами специальный лабораторный контроль не требуется, хотя целесообразно все же следить за уровнем тромбоцитов и периодически (1 раз в 3–4 дня) определять АЧТВ, особенно если больной, помимо гепарина, принимает препараты, оказывающие влияние на свертываемость крови (например НПВC). Продолжительность лечения больных ТЭЛА низкомолекулярными гепаринами составляет 7–10 дней.
Непрямые антикоагулянты.Одновременно с применением гепарина больным ТЭЛА уже на 2–3 день заболевания назначают так называемые непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Как известно, витамин К необходим для активации некоторых факторов свертывания крови (II, VII, IX, Х), а также протеинов С и S. Нарушение метаболизма витамина К под действием непрямых антикоагулянтов приводит к выраженному снижению участия этих факторов свертывания в процессе коагуляции. В последние годы наиболее широкое распространение в мировой клинической практике получил варфарин, который успешно используется в качестве непрямого антикоагулянта на протяжении более 50 лет. Недавно препарат разрешен для применения в Российской Федерации.
У больных ТЭЛА прием варфарина или других непрямых антикоагулянтов (синкумар, фенилин, пелентан и др.) в течение 5–8 суток сочетают с применением гепарина. Адекватность дозы этих ЛС контролируется с помощью определения протромбинового времени, величина которого должна превышать исходный уровень в 1,5–2,0 раза. При этом МНО (международное нормализованное отношение) должно быть на уровне 2,0–2,5. Общая продолжительность лечения непрямыми антикоагулянтами должна составлять не менее 3-х месяцев. В некоторых случаях, например у больных с отчетливо выраженным гиперкоагуляционным синдромом (см. ниже), непрямые антикоагулянты принимают в течение года и более.
К числу наиболее частых осложнений терапии непрямыми антикоагулянтами относятся кровотечения, в связи с чем их применение противопоказано у больных, страдающих язвенной болезнью желудка и двенадцатиперстной кишки, язвенным колитом, геморрагическими диатезами и другими заболеваниями, характеризующимися повышенным риском геморрагий.
При возникновении кровотечений на фоне приема непрямых антикоагулянтов необходимо отменить прием этих ЛС. Внутривенно вводится антагонист непрямых антикоагулянтов — витамин К в дозе 5–10 мг ежедневно. Следует помнить, что максимальная эффективность препарата наблюдается только через 20–24 ч после его введения. Поэтому при необходимости срочной остановки кровотечения следует провести трансфузию свежезамороженной плазмы в дозе 10–20 мл/кг массы тела, начав одновременно терапию витамином К.
Антитромботическая терапия. В связи с наличием серьезных побочных эффектов непрямых антикоагулянтов и необходимости постоянного контроля протромбинового времени и АЧТВ в последние годы для профилактики повторных тромбозов и тромбоэмболий все чаще используют длительное введение низкомолекулярных гепаринов и/или применение современных антитромбоцитарных препаратов (тиклопидина и клопидогреля). Как было показано в главе 5, оба препарата относятся к производным тиенопиридина и эффективно блокируют АДФ-рецепторы тромбоцитов, что способствует уменьшению их агрегации.
Тиклопидин применяют в дозе 250 мг 2 раза в сутки, а клопидогрель — 75 мг в сутки в течение длительного времени (от 3-х месяцев до года и более). Более эффективным и безопасным является клопидогрель, который в отличие от тиклопидина не вызывает у больных нейтропению и тромбоцитопению. Побочными эффектами клопидогреля являются диспепсические явления (диарея), желудочно-кишечные кровотечения (относительно редко), заболевания печени, язвенная болезнь желудка и двенадцатиперстной кишки.
Пока не доказана безопасность совместного применения клопидогреля и гепарина, поэтому у больных ТЭЛА целесообразно назначать клопидогрель либо после завершения курса низкомолекулярного гепарина, либо за несколько дней до его отмены.
| 14.5.2. Тромболитическая терапия |

|
Показанием для лечения больных ТЭЛА тромболитиками является массивная ТЭЛА, протекающая с выраженными расстройствами гемодинамики — шоком, острой правожелудочковой недостаточностью и высокой легочной артериальной гипертензией. Обычно применяют стрептокиназу, урокиназу или альтеплазу. Схема лечения аналогична таковой, применяемой для лечения больных с острым коронарным синдромом со стойким подъемом сегмента RS–Т (см. главу 6).
Перед лечением и через 4 ч от начала введения тромболитиков контролируют протромбиновое время, АЧТВ, тромбиновое время, уровень фибриногена и продуктов деградации фибрина. Если отсутствуют признаки растворения тромбов, скорость введения препаратов увеличивают в 2 раза.
Эффект тромболитической терапии оценивается по клиническим, и электрокардиографическим данным (уменьшение одышки, тахикардии, цианоза, регресс признаков электрической перегрузки правых отделов сердца), а также по результатам повторной вентиляционно-перфузионной сцинтиграфии или ангиопульмонографии.
| 14.5.3. Хирургическое лечение |

|
Хирургическое лечение показано при массивной ТЭЛА, особенно при развитии артериальной гипотонии и острого легочного сердца, в частности у больных, имеющих противопоказания для проведения тромболизиса или применения антикоагулянтов. Чаще всего производят эмболэктомию и устанавливают так называемый кава-фильтр, который препятствует повторной ТЭЛА даже при наличии флотирующего тромба в глубоких венах нижних конечностей.
| 14.6. Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей |

|
У больных с высоким риском тромбоза глубоких вен нижних конечностей (см. ниже) показано ультразвуковое допплеровское исследование вен. При обнаружении тромбоза, особенно при наличии в венах флотирующих тромбов, показано хирургическое вмешательство, направленное на предотвращение миграции тромба в легочную артерию. С этой целью используют установку кава-фильтра или способы парциальной окклюзии нижней полой вены с помощью специальных фильтров, устанавливаемых в просвет сосуда непосредственно ниже устья почечных вен. Большое значение имеет медикаментозная профилактика тромбозов глубоких вен нижних конечностей и ТЭЛА. С этой целью используют гепарины, антитромботические препараты и непрямые антикоагулянты (см. выше).
Дата добавления: 2016-04-22; просмотров: 1044;
