Ранние модели атома
Изучение прохождения электрического тока через различные среды (газы, растворы, расплавы), проводившееся в прошлом столетии, дало первые экспериментальные факты, натолкнувшие на мысль о сложном строении атома.
В 30-х годах XIX века английский физик Майкл Фарадей установил, что электрохимические процессы характеризуются определенными соотношениями, которые указывают на то, что электрические заряды, так же как и материя, имеют дискретный характер, и существует некий минимальный заряд.
Эксперименты с газоразрядными трубками, проведенные во второй половине прошлого века, с очевидностью показали, что в состав атомов должны входить отрицательно заряженные частицы, которые впоследствии были названы электронами[3]. Эти опыты с разреженными газами имели достаточно простое оформление. В стеклянную трубку впаивали два электрода, затем трубку вакуумировали до давления примерно 10 мм рт. ст. (0,013 Па). На электроды подавали высокое напряжение (несколько киловольт) и по свечению стенок трубки и остаточных газов наблюдали поток частиц, которые перемещались от отрицательного электрода к положительному. Если на пути этого пучка устанавливали какое-либо препятствие, например, вертушку, то она начинала вращаться, указывая, что частицы имеют конечную массу. Если газоразрядную трубку помещали между пластинами плоского конденсатора, то поток частиц отклонялся к одной из них, а именно к той, которая заряжена положительно, что говорило об отрицательном заряде частиц.
В 1896 году Анри Беккерель, работая с соединениями урана, открыл явление радиоактивности – самопроизвольного распада атомов одного элемента и превращения их в атомы другого химического элемента. При этом было обнаружено, что такие превращения сопровождаются испусканием невидимых глазом излучений.
Несколько позже супруги Пьер Кюри и Мария Склодовская-Кюри обнаружили, что невидимое излучение испускают не только соединения урана, но и другие вещества. В результате кропотливой работы ими были открыты два новых химических элемента, которые были названы “радий” и “полоний”.
В 1899 г. Резерфорд обнаружил, что радиоактивные элементы испускают два вида излучений, которые он назвал a- и b-лучи. Позже было установлено, что радиоактивные вещества могут испускать три вида излучений: a, b и g. a-излучение представляет собой поток ядер атомов гелия и, соответственно, a-частицы имеют массу 4 а. е. м. и электрический заряд +2, b-лучи – это поток электронов, а g-лучи – электромагнитное излучение с очень короткой длиной волны[4].
Все эти экспериментальные факты говорили о том, что атом имеет сложное строение и в его состав должны входить электроны. А т. к. атом в целом является электронейтральной частицей, то отрицательный заряд электронов должен компенсироваться положительным зарядом.
Около 1900 г. Дж. Дж. Томсон предлагает первую модель атома, согласно которой положительный заряд равномерно заполняет весь объем атома, а отрицательный, представленный электронами, вкраплен в эту положительно заряженную сферу. Эта модель получила название «пудинг Томсона». Все полученные к тому времени экспериментальные данные модель объяснить не могла. Она в какой-то мере объясняла опыты Фарадея и эксперименты с газоразрядными трубками, но не могла ответить на самый главный вопрос: «как вообще может существовать такая система электрических зарядов?»[5] Несмотря на это, ученые некоторое время пользовались этой моделью.
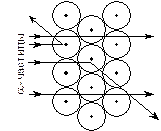
Рис. 1. Опыт по прохождению a-частиц через вещество.
В 1910 г. студенты Резерфорда Ханс Гейгер и Эрнест Марсден проводили эксперименты по бомбардировке a-частицами тонких металлических пластинок. Они обнаружили, что большинство a-частиц проходят через фольгу, не изменяя своей траектории. И это было неудивительно, если принять правильность модели атома Томсона.
Удивительным было как раз то, что некоторые частицы отклонялись от первоначальной траектории и к всеобщему удивлению примерно 1 из 20 000 a-частиц отклонялась на угол близкий к 180°, т. е. отскакивала обратно (см. рис. 1).
Из результатов этого эксперимента можно было сделать следующие выводы:
1) в атоме есть некоторое «препятствие», которое было названо ядром;
2) ядро имеет положительный заряд (иначе положительно заряженные a-частицы не отражались бы назад);
3) ядро имеет очень маленькие размеры по сравнению с размерами самого атома (лишь незначительная часть a-частиц изменяла направление движения);
4) ядро имеет большую массу, по сравнению с массой a-частиц.
Эксперименты по рассеянию a-частиц позволили также оценить размеры ядер и атомов:
‑ ядра имеют диаметры порядка 10–15 – 10–14 м,
‑ атомы имеют диаметры порядка 10–10 м.
Для объяснения полученных результатов Резерфорд выдвинул идею планетарного строения атома. Он рассматривал атом как подобие Солнечной системы: в центре – ядро, содержащее основную массу и весь положительный заряд атома, а вокруг, по разным орбитам, вращаются электроны. Эта модель довольно хорошо объясняла накопившийся к тому времени экспериментальный материал, но страдала двумя недостатками:
1) В соответствии с уравнениями классической электродинамики заряженная частица, движущаяся с ускорением (а электрон в атоме движется с центростремительным ускорением), должна излучать энергию. При этом потеря энергии должна приводить к уменьшению радиуса орбиты и падению электрона на ядро.
2) Непрерывное изменение траектории электрона должно способствовать и непрерывному изменению частоты излучения и, следовательно, непрерывному спектру испускания. Но эксперименты показывали, что спектр испускания водорода, а также других атомов, находящихся в газообразном состоянии, состоит из нескольких полос, т. е. имеет дискретный характер.
Выход из создавшегося положения был найден в 1913 году датским физиком Нильсом Бором, который предложил свою теорию строения атома. При этом он не отбрасывал полностью прежние представления о планетарном строении атома, но для объяснения устойчивости такой системы сделал предположение, что законы классической физики не всегда применимы для описания таких систем, как атомы, и сформулировал два постулата.
Первый постулат Бора. Электроны могут вращаться вокруг ядра по строго определенным стационарным орбитам, при этом они не излучают и не поглощают энергию.
Второй постулат Бора. При переходе с одной орбиты на другую электрон поглощает или испускает квант энергии.
Бор предположил, что момент импульса для электрона в атоме может принимать дискретные значения, равные только целому числу квантов действия 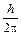 , что математически может быть записано так:
, что математически может быть записано так:
mvr =  , (7)
, (7)
где m – масса электрона, v – линейная скорость его вращения, r – радиус орбиты, n – главное квантовое число, принимающее целочисленные значения от 1 до бесконечности, а h = 6,625 × 10–34 Дж/с – постоянная Планка. Уравнение (7) представляет собой математическое выражение первого постулата Бора.
Энергия электрона на соответствующей орбите определяется выражением:
E = 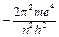 . (10)
. (10)
В этом уравнении, все величины, кроме n, являются константами. Таким образом, энергия электрона в атоме определяется значением главного квантового числа. Для атома водорода при n = 1, E = 2,176 × 10–18 Дж, или 13,6 эВ (1 электронвольт – это энергия, которую приобретает электрон, проходя разность потенциалов в 1 вольт, и равна 1,6 × 10–19 Дж).
Используя приведенные выше уравнения, Бор рассчитал спектр излучения атома водорода.
В атоме водорода электрон имеет минимальную энергию на первой орбите. Такое состояние электрона называется основным, или не возбужденным. Если этому электрону сообщить достаточную энергию, то он может перейти на другую орбиту с большим радиусом, например на орбиту № 2, 3 и т. д., в зависимости от сообщенной энергии. Такое состояние называется возбужденным, оно является неустойчивым. Электрон может находиться на этих орбитах непродолжительное время, а затем переходит на другую орбиту с меньшей энергией, в конечном итоге возвращаясь в основное состояние. При этих переходах происходит испускание энергии в виде электромагнитного излучения.
В 1900 г. Планк предположил, что излучение и поглощение энергии может происходить только строго определенными порциями, названными им квантами. Частота излучения связана с энергией уравнением:
E = hn или E =  , (11)
, (11)
где c – скорость света в вакууме равная 3 × 108 м/с. Поэтому частота этого излучения зависит от разности между энергиями уровней (DE ). В зависимости от длины волны l это излучение может относиться к различным областям спектра: рентгеновской, ультрафиолетовой, видимой или инфракрасной. На рис. 2 схематически показаны переходы электрона в возбужденном атоме водорода, которые вызывают излучение в различных областях спектра.

Рис. 2. Электронные переходы в атоме водорода,
соответствующие разным сериям.
Расчеты Бора оказались в великолепном согласии с результатами, полученными экспериментально (см. табл. 6).
Таблица 6
Длины волн спектральных линий в серии Бальмера (видимая область)
| l, нм (эксперимент) | l, нм (расчетные) |
| 656,466 | 656,47 |
| 486,271 | 486,28 |
| 434,171 | 434,17 |
| 410,291 | 410,293 |
| 397,12 | 397,123 |
При детальном изучении спектральных линий оказалось, что некоторые из них представляют собой не одну, а несколько близко расположенных линий. Это указывало на то, что существуют различные орбиты, на которых электроны имеют близкие значения энергий. Для объяснения этого факта Зоммерфельд предположил, что электроны могут вращаться не только по круговым, но и по эллиптическим орбитам.
Однако теория Бора не являлась универсальной. С ее позиций нельзя было описать поведение атома водорода в магнитном поле. Не удается также объяснить образование молекулы водорода, возникают непреодолимые трудности принципиального характера при описании многоэлектронных атомов. Боровская теория в химии практически не используется.
Указанные трудности можно преодолеть, если подходить к описанию строения атома с позиций более широкой теории – квантовой механики, рассматривающей поведение частиц в микромире. Законы, которые описывают явления, происходящие в микромире, существенно отличаются от законов, описывающих поведение макротел. Квантовое число n, которое было искусственно введено в теории Бора, оказывается с точки зрения квантовой теории неизбежным следствием более общих законов.
Двойственная природа микромира была впервые установлена для света. С одной стороны, для света характерны такие явления как интерференция и дифракция, которые могут быть объяснены только с позиций его волновой природы. С другой стороны, явление фотоэффекта с позиций этой теории описать невозможно. Это можно сделать, предположив для света корпускулярную (от лат. corpusculum – частица) природу. В 1905 г. Эйнштейн высказал мысль, согласно которой свет испускается в виде частиц, названных фотонами или квантами. Каждый фотон обладает энергией, определяемой уравнением (11).
Из корпускулярной природы света следовало, что фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн предложил уравнение эквивалентности массы и энергии:
E = mc2. (12)
Объединяя уравнения (11) и (12) получим:
m =  ; p = mc =
; p = mc = 
или
l =  , (13)
, (13)
где p – импульс фотона.
В 1924 г. французский физик де Бройль исходя из представления о двойственной природе микромира, предположил, что электрон имеет определенную длину волны, которая укладывается на орбите целое число раз. Это означает, что 2pr = nl.
Предположение де Бройля в 1927 году получило экспериментальное подтверждение. Американские физики Девисон и Джермер наблюдали дифракцию электронов на кристаллах хлорида натрия.
В теорию Бора принцип квантования был введен произвольно. В ней в основном использовались законы классической механики. Открытие волновых свойств электрона, фотоэффект, опыты с абсолютно черным телом привели к созданию нового раздела физики – квантовой механики. Большую роль в ее создании сыграли Э. Шредингер и В. Гейзенберг.
Квантовомеханическая модель атома не такая наглядная, как модель, предложенная Бором, а математический аппарат квантовой механики несравненно сложнее. Поэтому основные положения квантовомеханической модели строения атома будут рассмотрены чисто качественно, без использования математического аппарата. Многое из того, что будет изложено в следующем разделе, читателю придется принять «на веру», без доказательств. Квантовые числа будут просто введены для описания поведения электрона в атоме, в то время как они являются следствием решения уравнения Шредингера.
Дата добавления: 2016-02-13; просмотров: 1649;
