Метод валентных связей
В методе валентных связей химическая связь рассматривается как двухэлектронная и двухцентровая, т. е. пара электронов, образующих связь, локализована в пространстве между двумя атомами и находится в их общем пользовании. Возможны два механизма образования общей электронной пары. Первый называется обменным и заключается в спаривании двух электронов, принадлежащих разным атомам и имеющим противоположные спины. Его можно выразить следующей схемой:
 +
+  =
= 
Второй механизм, называемый донорно-акцепторным, приводит к образованию химической связи за счет предоставления одним атомом в общее пользование пары электронов, а другим – свободной орбитали. Атом, предоставляющий электронную пару, называется донором, а атом, имеющий свободную орбиталь, – акцептором. Схема образования связи в этом случае выглядит так:
 +
+  =
= 
Рассмотрим возможности предсказания состава химических соединений между водородом и элементами второго периода Периодической системы: Li, Be, B, C, N, O, F, так как в атоме водорода имеется только один электрон, и образование связи будет происходить по обменному механизму.
Атом лития на 2s-подуровне имеет один неспаренный электрон и, следовательно, соединение должно иметь состав LiH. У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (C, N, O, F) происходит последовательное заполнение 2p-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения: BH, CH2, NH3, H2O, HF. Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными: бериллий образует соединение с водородом состава BeH2, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав CH4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т. е. происходит распаривание s-электронов и переход их на p-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии s- и p-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э–Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий s- и p-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см. рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации:
sp-гибридизация. В этом явлении принимают участие s- и одна p-орбитали, и в результате образуются две орбитали нового типа, которые называются sp-гибридными. Эти орбитали имеют форму, показанную на рисунке, оси их лежат на одной прямой, образуя угол 180°. В образовании связей в молекуле BeH2 принимают участие sp-гибридные орбитали атома бериллия и молекула имеет линейное строение;



Рис. 14. Пространственное расположение электронных облаков для различных типов гибридизации.
sp2-гибридизация. Во взаимодействие вступают s- и две p-орбитали, в результате чего образуются три орбитали нового типа, которые называются sp2-гибридными (см. рис. 14.). Оси этих орбиталей лежат в одной плоскости, и углы между ними равны 120°. Например, атом бора в молекуле BF3 находится в sp2-гибридном состоянии, и эта молекула имеет форму правильного треугольника с атомом бора в центре;
sp3-гибридизация. В этом случае исходными являются s- и три p-орбитали. В результате гибридизации образуются четыре новые орбитали – sp3-гибридные (см. рис.14.). Оси этих орбиталей направлены от центра к вершинам тетраэдра, углы между осями равны 109°28¢. CH4 – молекула метана, где реализуется этот тип гибридизации, имеет тетраэдрическое расположение атомов водорода. В молекуле аммиака (NH3) атом азота тоже находится в sp3-гибридном состоянии, три пары электронов являются общими с атомами водорода и участвуют в образовании связей, а одна электронная пара (неподеленная электронная пара) принадлежит только атому азота. Для предсказания геометрии молекулы аммиака атом азота следует поместить в центр тетраэдра, атомы водорода – в три вершины, а неподеленную электронную пару – в четвертую вершину. Естественно, положение этой электронной пары экспериментальными методами зафиксировать невозможно, находят лишь положения атомов водорода и азота. Все это приводит к тому, что молекула аммиака имеет пирамидальную форму. Аналогично можно рассмотреть строение молекулы воды. В ней две неподеленные электронные пары кислорода занимают две вершины тетраэдра, а две другие заняты атомами водорода, что приводит к угловой форме молекулы воды. Описывать геометрию молекулы HF с этих позиций не имеет смысла, т. к. ясно, что она будет линейна, поскольку через две точки можно провести одну прямую линию.
Неподеленная электронная пара образует более размытое «электронное облако», чем связывающая (обобществленная, общая), поэтому она занимает больший объем, приводя к уменьшению валентных углов по сравнению с тетраэдрическими.
Валентные электроны располагаются не только на s- и p-орбиталях, но и на d. Последние также принимают участие в образовании гибридных орбиталей. Осуществляются два случая гибридизации с участием d-орбиталей: sp3d2 и sp3d. В первом случае молекула реализует октаэдрическое строение, а во втором образуется тригональная бипирамида.
Предположение об образовании гибридных орбиталей было большим достижением теории валентных связей, но не описывало все возможные пространственные конфигурации молекул, встречающиеся в природе.
Более общую теорию пространственного строения молекул предложил Гиллеспи, исходя из чисто электростатических представлений. Она базировалась на большом экспериментальном материале, обобщенном Сидвиком и Пауэллы. Основные положения теории заключаются в следующем:
1. Геометрия молекулы или иона определяется исключительно числом электронных пар на валентной оболочке центрального атома.
2. Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т. е. электронные пары ведут себя так, как если бы они взаимно отталкивались. Геометрические многогранники, реализующиеся при этом, подчиняются формуле Декарта-Эйлера: «число вершин + число граней – число ребер равно двум».
3. Область пространства, которую занимает несвязывающая неподеленная пара электронов имеет большие размеры, чем та область, которая занята связывающей электронной парой.
4. Размер области пространства, занятой связывающей парой электронов, уменьшается с увеличением электроотрицательности лиганда и с уменьшением электроотрицательности центрального атома.
5. Две электронные пары двойной связи занимают большую область пространства, чем одна электронная пара простой связи.
Обозначения, использованные для описания геометрической конфигурации молекул
А – многовалентный атом
X – атомы, связанные с атомом А
n – число атомов X
E – неподеленная пара электронов
m – количество неподеленных электронных пар
Тогда формула молекулы по Гиллеспи записывается так: AXnEm. Геометрия молекулы зависит от суммы n + m. Число n, определяющее количество атомов X, непосредственно присоединенных к атому A, равно и его координационному числу. Каждая электронная пара принимается за точечный заряд. Центральный атом А помещается в центр сферы некоторого радиуса, который для однотипных присоединенных атомов X равен длине связи A–X. На поверхности сферы располагаются точечные электронные пары. Применяя правило максимального удаления электронных пар на сфере друг от друга, можно вывести геометрию простейших молекул и ионов, постепенно увеличивая сумму поделенных и неподеленных пар (см. рис. 15.).
Молекулу AX рассматривать не имеет смысла, так как она всегда линейна, сколько бы атом А ни имел неподеленных электронных пар.
Молекула AX2 также всегда линейна, так как максимальное отталкивание двух электронных пар располагает их на концах диаметра условной сферы.
Три связывающие электронные пары, максимально удаленные друг от друга, образуют правильный треугольник (молекулы AX3). В этом случае угол X-A-X равен 120°. Такое строение имеют молекулы BF3, AlF3. Если одну из связывающих электронных пар заменить неподеленной парой электронов, молекула будет описываться формулой AX2E и иметь угловое строение, причем, согласно третьему правилу Гиллеспи, угол X-A-X станет меньше 120°. Примером такой геометрии может служить молекула SnF2.
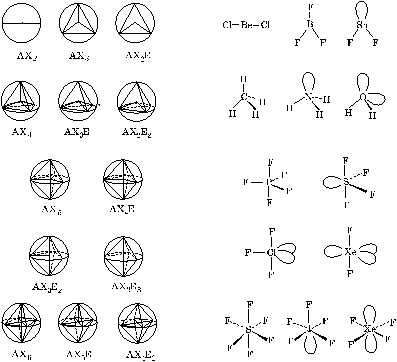
Рис. 15. Зависимость геометрии молекул от расположения атомов и электронных пар на поверхности сферы.
Четыре связывающие пары электронов в пространстве образуют тетраэдр. По Гиллеспи, это тип AX4. Угол X-A-X составит 109°28¢. Типичными представителями этого типа молекул являются молекулы CH4, CCl4, SnF4. Последовательно уменьшая число связывающих пар электронов и увеличивая число неподеленных электронных пар, для молекул типа AX3E приходим к их тригональному пирамидальному строению, а для молекул типа AX2E2 – к угловому. Такая геометрия получается, если в вершинах тетраэдра последовательно локализуются неподеленные электронные пары, что приводит к уменьшению тетраэдрического угла. Примером молекулы типа AX3E является молекула аммиака NH3, а типа AX2E2 – молекула воды H2O.
Координационное число “пять” реализуется в молекулах типа AX5. Примерами подобных молекул являются пентафторид и пентахлорид фосфора (PF5, PCl5). Пять атомов галогенов в пространстве занимают вершины тригональной бипирамиды. Три атома располагаются в экваториальной плоскости, образуя равнобедренный треугольник, а два – соответственно над и под этой плоскостью. Расстояние A–X от центра молекулы до одной из вершин пирамиды, называемое аксиальным, больше аналогичного экваториального. Валентный угол между связями, лежащими в экваториальной плоскости, равен 120°, а в аксиальной – 180°. При выводе геометрической формы молекул, являющимися производными от тригональной бипирамиды, для неподеленных электронных пар возникают две альтернативные возможности расположения. При аксиальном расположении она испытывает отталкивание от трех близлежащих атомов, а в экваториальной – от двух. Поэтому первые неподеленные пары электронов всегда занимают экваториальное положение как энергетически наиболее выгодное. Примером может служить молекула тетрафторида серы SF4, которая имеет форму качелей или дисфеноида. В молекулах типа AX3E2, таких, как ClF3 или ICl3, вторая неподеленная электронная пара располагается также в экваториальной плоскости. Поэтому все четыре атома находятся в одной плоскости, напоминая по форме букву Т. За счет того, что неподеленная пара электронов занимает область пространства большего размера, происходит искажение соответствующих валентных углов в сторону их уменьшения. Третья неподеленная пара электронов, также занимая положение в экваториальной плоскости, преобразует Т-образную молекулу в линейную. Представителем молекул типа AX2E3 является молекула XeF2.
Наиболее выгодное размещение шести атомов X вокруг центрального атома A – октаэдрическое. Молекулы типа AX6, например SF6, имеют форму октаэдра. Первая неподеленная пара электронов занимает любую из вершин октаэдра, превращая его в квадратную пирамиду. Примером молекулы типа AX5E может служить IF5. Для второй электронной пары имеются две возможности расположения: по соседству с первой (цис-положение) и напротив нее (транс-положение). Максимальное отталкивание заставляет принять транс-ориентацию двух электронных пар. Вследствие этого молекулы типа AX4E2 имеют форму квадрата, например, XeF4. Увеличивая дальше число неподеленных пар электронов для молекул типа AX3E3 и AX2E4, легко прийти к выводу соответственно о Т-образном и линейном их строении. Примеры веществ с таким типом молекул неизвестны.
Аналогичным образом, исходя из теории максимального отталкивания электронных пар, можно предсказать строение молекул с числом электронных пар более шести. Но соединения такого состава практически в дальнейшем встречаться не будут, и поэтому ограничимся лишь рассмотрением геометрии молекул, описанных выше.
Таким образом, теория валентных связей и максимального отталкивания электронных пар обладает лишь предсказательной силой в обосновании геометрии молекул. Объяснить же многие другие экспериментальные факты они не могут. Эти методы несостоятельны при описании электрондефицитных молекул, таких как бороводороды, с нечетным числом электронов. Они также испытывают большие трудности при объяснении цвета соединений и предсказании их магнитных свойств.
Дата добавления: 2016-02-13; просмотров: 2397;
