Квантовомеханическая модель строения атома
Гейзенберг указал на принципиальные различия в наблюдении за микро- и макрообъектами. Наблюдение за любым объектом, в принципе, сводится к двум случаям:
1) Объект сам подает какие-либо сигналы. Например, шум от работающего двигателя, тепловое излучение и т. п.
2) На наблюдаемый объект оказывается какое-то воздействие, например, облучение светом, радиоволнами и т. п., и регистрируется отраженный сигнал (как это широко используется в радиолокации, в эхолокации). Причем, чем сильнее воздействие на наблюдаемый объект, тем сильнее (при прочих равных условиях) отраженный сигнал и надежнее регистрация объекта.
Если ведется наблюдение за привычными для нас макрообъектами, то действие на них электромагнитного излучения (свет, радиоволны и т. д.) не изменяют ни их положения, ни их скорости. Совершенно иначе обстоит дело при наблюдении объектов микромира, например, электронов. При действии кванта света на электрон скорость последнего не остается без изменения. Поэтому, определив при действии фотона положение электрона в какой-то момент времени, мы не в состоянии в это же мгновение определить его скорость – она уже изменилась.
Гейзенберг предложил соотношение, которое получило название «соотношение неопределенностей»:
DpDx > 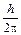 , (14)
, (14)
где Dp – неопределенность в значении импульса частицы, а Dx – не-определенность в ее координатах. Из этого соотношения следует, что чем точнее определены координаты электрона, тем с меньшей точностью будет определен его импульс и наоборот. Иными словами, говорить о траектории электрона не имеет смысла, так как для описания последней необходимо точно знать и координаты электрона и его импульс в каждый момент времени (что было заложено в модель атома Бора). Соотношение неопределенностей показывает, что столь точное описание движения такой маленькой частицы, как электрон, невозможно, т. е. само понятие орбита (траектория) электрона оказывается несостоятельным. Необходим совершенно иной метод описания поведения электрона в атоме, который дает квантовая механика. В квантовой механике для описания поведения электрона исходными являются два положения:
1) движение электрона носит волновой характер;
2) наши знания о поведении электрона имеют вероятностный (или статистический) характер.
Некоторые разъяснения по первому положению были уже даны (на стр. 25). Прокомментируем второе положение. В соответствии с принципом неопределенности Гейзенберга никогда нельзя точно установить место нахождения частицы. Лучшее, что можно сделать в этом случае, это указать вероятность, с которой частица будет находиться в области пространства DV = Dx × Dy × Dz.
В 1926 г. Шредингер предложил уравнение, в которое для описания поведения электрона в атоме была введена волновая функция. Уравнение имеет обманчиво простой вид:
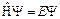 , (15)
, (15)
где E – полная энергия частицы, Y – волновая функция, 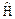 – оператор Гамильтона. Гамильтониан показывает, какие математические операции нужно произвести с волновой функцией, чтобы решить уравнение относительно энергии. Физический смысл волновой функции определить трудно, а вот квадрат модуля ее | Y |2 определяет вероятность нахождения электрона в данной области пространства.
– оператор Гамильтона. Гамильтониан показывает, какие математические операции нужно произвести с волновой функцией, чтобы решить уравнение относительно энергии. Физический смысл волновой функции определить трудно, а вот квадрат модуля ее | Y |2 определяет вероятность нахождения электрона в данной области пространства.
Уравнение Шредингера точно решается для водорода и водородоподобных атомов (т. е. для систем, состоящих из ядра и одного электрона). Из решения этого уравнения для атома водорода вытекало, что поведение электрона в атоме описывается четырьмя квантовыми числами.
1°. Главное квантовое число n. Оно может принимать значения от 1 до бесконечности, которые определяют:
а) номер энергетического уровня (в теории Бора – номер орбиты);
б) интервал энергий электронов, находящихся на этом уровне;
в) размеры орбиталей (в теории Бора – радиусы орбит);
г) число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т. д.).
д) в Периодической системе Д. И. Менделеева значению главного квантового числа соответствует номер периода.
Иногда пользуются буквенными обозначениями главного квантового числа, т. е. каждому численному значению n соответствует определенное буквенное обозначение:
Таблица 7Буквенные обозначения главного квантового числа
| Численные значенияn | |||||
| Буквенное обозначение | K | L | M | N | O |
2°. Орбитальное или азимутальное квантовое число l. Орбитальное квантовое число определяет момент количества движения (момент импульса) электрона, точное значение его энергии и форму орбиталей.
Новое понятие «орбиталь» по звучанию напоминает слово «орбита», но имеет совершенно иной смысл. Орбиталь – это область пространства, в которой вероятность нахождения электрона имеет определенное значение (90 – 95 %). Иногда орбиталью называют граничную поверхность этой области, а на рисунках, как правило, изображают сечение этой области плоскостью, проходящей через начало координат и лежащей в плоскости рисунка. В начало координат помещают центр ядра атома. Понятие орбиталь, в отличие от орбиты, не подразумевает знания точных координат электрона. Орбитальное квантовое число зависит от главного квантового числа и принимает следующие значения:
l = 0, 1, … , (n – 1),
причем каждому значению главного квантового числа n соответствует n значений орбитального квантового числа l. Например, если n = 1, то l принимает только одно значение (l = 0) при n = 2 величина l принимает двазначения: 0 и 1 и т. д. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение. Первые четыре буквенныx обозначения имеют историческое происхождение и связаны с характером спектральных линий, соответствующих электронным переходам между этими подуровнями: s, p, d, f – первые буквы английских слов, использованных для названия спектральных линий sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения других подуровней идут в алфавитном порядке: g, h, … .
Таблица 8Число подуровней, определяемых значением n
| Значениеn | |||||||||||||||
| Значение l | |||||||||||||||
| Буквенное обознач. l | s | s | p | s | p | d | s | p | d | f | s | p | d | f | g |
| Число подуровней |
Любой подуровень определяется двумя квантовыми числами – главным (при записи обычно указывают численное значение) и орбитальным (при записи обычно используют буквенное обозначение ). Например, энергетический подуровень, для которого n = 2 и l = 1 следует записать так: 2p-подуровень. Все орбитали с одинаковыми значениями l имеют одинаковую геометрическую форму и, в зависимости от значений главного квантового числа различаются размерами, т. е. являются подобными фигурами. Например, все орбитали, для которых l = 0 (s-орбитали) имеют форму сферы, но различаются радиусами, в зависимости от значения главного квантового числа n. Чем больше значение n, тем больше размеры орбиталей, например, 1s-орбиталь имеет наименьшие размеры, радиус 2s-орбитали больше, 3s-еще больше.
3°. Магнитное квантовое число ml . Вращение электрона вокруг ядра можно сравнить с движением тока по замкнутому контуру. При этом возникает магнитное поле, напряженность которого направлена перпендикулярно плоскости вращения электрона. Если атом находится во внешнем магнитном поле, то, согласно квантовомеханическим представлениям, его электроны должны расположиться так, чтобы проекции их магнитных моментов на направление этого поля были целочисленными (см. рис. 3). При этом они могут принимать как отрицательные, так и положительные значения, включая нулевое.
Численное значение проекции магнитного момента и является магнитным квантовым числом. Если значение орбитального квантового числа равно l, то магнитное квантовое число будет принимать значения от – l до + l, включая ноль. Общее количество значений будет равно 2l + 1.
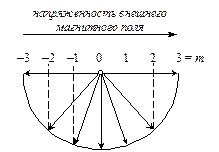
Рис. 3. Физический смысл магнитного квантового числа
Таким образом, магнитное квантовое число определяет расположение орбиталей в пространстве относительно выбранной системы координат. Общее число возможных значений ml показывает, сколькими способами можно расположить орбитали данного подуровня в пространстве, т. е. общее число орбиталей на подуровне.
Таблица 9Число орбиталей на подуровне
| n | ... | ||||||
| l | ... | ||||||
| ml | – 1, 0, + 1 | – 1, 0, + 1 | – 2, – 1, 0, + 1, + 2 | ... | |||
| Число орбиталей на подуровне | ... |
Орбитальному квантовому числу l = 0 соответствует единственное значение магнитного квантового числа ml = 0. Эти значения характеризуют все s-орбитали, которые имеют форму сферы. Т. к. в этом случае магнитное квантовое число принимает только одно значение, каждый s-подуровень состоит только из одной орбитали. Рассмотрим любой p-подуровень: при l = 1 орбитали имеют форму гантелей (объемные «восьмерки»), магнитное квантовое число принимает следующие значения ml = – 1, 0, + 1 (три значения), следовательно, p-подуровень состоит из трех орбиталей, и эти орбитали располагаются вдоль трех осей координат и, соответственно, обозначаются px, py, pz. Для d-подуровня l = 2, ml = – 2, – 1, 0, + 1, + 2 (5 значений), и любой d-подуровень состоит из пяти орбиталей, которые определенным образом расположены в пространстве (см. рис. 6) и соответственно обозначаются dxy, dxz, dzy, 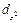 и
и 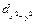 . Четыре из пяти d-орбиталей имеют форму четырехлепестковых розеток, каждая из которых образована двумя гантелями, пятая орбиталь представляет собой гантель с тором в экваториальной плоскости (
. Четыре из пяти d-орбиталей имеют форму четырехлепестковых розеток, каждая из которых образована двумя гантелями, пятая орбиталь представляет собой гантель с тором в экваториальной плоскости ( 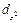 -орбиталь) и расположена вдоль оси z. «Лепестки» орбитали
-орбиталь) и расположена вдоль оси z. «Лепестки» орбитали 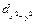 расположены вдоль осей x и y. Орбитали dxy, dxz и dyz расположены между соответствующими осями.
расположены вдоль осей x и y. Орбитали dxy, dxz и dyz расположены между соответствующими осями.
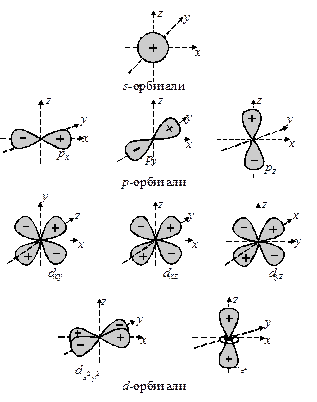
Рис. 4. Пространственные конфигурации s-, p- и d-орбиталей
Четвертый энергетический уровень состоит из четырех подуровней – s, p, d и f. Первые три из них аналогичны рассмотренным выше, а четвертый – f-подуровень состоит уже из семи орбиталей, пространственные конфигурации которых достаточно сложны, и рассматривать их мы не будем.
4°. Спиновое квантовое число (спин электрона), ms. В 1926 г. Уленбек и Голдсмит показали, что помимо орбитального движения электрон должен участвовать во вращении вокруг собственной оси, проходящей через центр. Поэтому электрон должен иметь собственный момент импульса, а так как он является заряженной частицей, то и магнитный момент. Это представление довольно примитивно, но используется для наглядности, поэтому мы будем им пользоваться. Возможны только два направления вращения электрона вокруг своей оси: по и против часовой стрелки. Следовательно, спиновое квантовое число принимает лишь два значения: 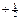 и
и 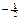 .
.
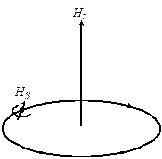
Рис. 5. Возникновение спина электрона (согласно Уленбеку и Голдсмиту)
Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел. Понятие «орбиталь» было дано выше (см. стр. 29). Определим четче некоторые термины, которые использовались при разъяснении физического смысла квантовых чисел и будут использоваться в дальнейшем.
Группа орбиталей, имеющих одинаковое значение орбитального квантового числа, образует энергетический подуровень.
Совокупность всех орбиталей с одинаковым значением главного квантового числа, т. е. орбиталей с близкими значениями энергий, образует энергетический уровень.
Если при описании строения атома водорода не возникает особых проблем – всего один электрон, который в основном состоянии должен занимать орбиталь с минимальной энергией, то при описании строения многоэлектронных атомов необходимо учитывать взаимодействие электрона не только с ядром, но и с другими электронами. Отсюда возникает проблема последовательности заполнения электронами различных подуровней в атоме. Эта последовательность определяется тремя «правилами».
1. Принцип Паули. В одном атоме не может быть двух электронов с одинаковым набором значений всех четырех квантовых чисел.
Это означает, что электроны должны отличаться значением хотя бы одного квантового числа. Первые три квантовых числа характеризуют орбиталь, на которой находится электрон. И если два электрона имеют одинаковый их набор, то это означает, что они находятся на одной и той же орбитали. В соответствии с принципом Паули они должны отличаться значением спина. Из этого следует, что на одной орбитали могут находится только два электрона с противоположными по знаку значениями спина.
Для определения «емкости» энергетического уровня, т. е. максимального числа электронов, которые могут находиться на уровне с главным квантовым числом n, составим следующую таблицу:
Таблица 10Максимальная электронная емкость первых трех энергетических уровней
| n | l | ml | s | число электронов на подуровне | |
| 0(s) | ± 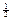
| ||||
| 0(s) | ± 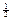
| ||||
| 1(p) | –1, 0, +1 | ± 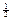
| |||
| 0(s) | ± 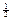
| ||||
| 1(p) | –1, 0, +1 | ± 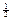
| |||
| 2(d) | –2, –1, 0, +1, +2 | ± 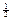
|
Из таблицы видно, что число орбиталей на данном энергетическом уровне в зависимости от значения n образует арифметическую прогрессию, где первый член a1 = 1, а последний – an = 2l + 1. Разность прогрессии равна 2, а число членов – n. Сумма Sn прогрессии в этом случае будет равна:
Sn = 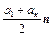 =
= 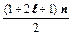 = (l + 1)n,
= (l + 1)n,
а с учетом l = n – 1
Sn = (n – 1 + 1)n = n2.
Таким образом, общее число орбиталей на энергетическом уровне со значением главного квантового числа n равно n2. А так как на одной орбитали может находиться лишь два электрона, получаем, что максимальная электронная емкость энергетического уровня составляет 2n2.
Существует определенная форма записи состояния электрона в атоме. Например, для основного состояния атома водорода она выглядит так:
| число электронов | |
 Уровень Уровень
| 1s1 | |
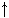
| подуровень |
Это означает, что на первом энергетическом уровне на s-подуровне находится один электрон. Существует и другая форма записи распределения электронов по подуровням – с помощью квантовых ячеек. Орбиталь в этом случае принято условно обозначать квадратами, а электроны – стрелками или ¯, в зависимости от знака спина. Тогда электронное строение атома водорода можно изобразить так:
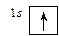
Электронное строение атома с бóльшим числом электронов, например атома бора, можно записать следующими способами:
1s22s22p1 или 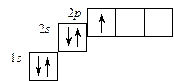
2. Правило Хунда. Это правило определяет последовательность заполнения орбиталей электронами в пределах одного подуровня.
Правило Хунда формулируется так: «В пределах одного подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный спин был максимальным, т. е. на подуровне должно быть максимальное число неспаренных электронов». Рассмотрим выполнение этого правила на примере заполнения p-подуровня.
| 1 вариант суммарный спин | 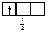
| 
| 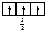
| 
| 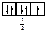
| 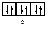
|
| 2 вариант суммарный спин | 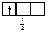
| 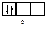
| 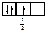
| 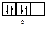
| 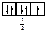
| 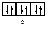
|
В соответствии с правилом Хунда заполнение орбиталей происходит по первому варианту, т. е. сначала электроны занимают все свободные орбитали и только потом происходит их спаривание.
3. Принцип наименьшей энергии (правило Клечковского). Заполнение энергетических уровней в водородоподобных атомах (микросистема, состоящая из ядра и одного электрона) происходит в соответствие с монотонным ростом главного квантового числа n (n = 1, 2, 3, … и т. д.). При каждом значении n заполнение подуровней должно осуществляться в порядке возрастания орбитального квантового числа l, которое принимает значения от 0 до (n – 1). И заполнение следующего энергетического уровня начинается только в том случае, когда предыдущий уровень заполнен полностью. Максимальное число электронов на энергетическом уровне определяется формулой 2n2 и, следовательно, максимальные числа электронов в периодах должны быть следующими:
Таблица11Предполагаемое число электронов в периодах
| № периода (n) | Максимальное число электронов |
Реально же в Периодической системе наблюдается другая картина:
Таблица12Реальное число электронов в периодах
| № периода (n) | Максимальное число электронов |
Как видно из этой таблицы, периоды располагаются парами, исключение составляет только первый период, содержащий всего два элемента, у которых заполняется первый энергетический уровень, состоящий из одного подуровня, и нет внутренних электронов, которые могли бы повлиять на строение внешнего уровня. В остальных же случаях наблюдается следующая картина: строение третьего периода подобно строению второго (и оба содержат по 8 элементов), строение пятого периода подобно строению четвертого (и в обоих по 18 элементов), – седьмого подобно строению шестого (по 32 элемента).
Значительно лучшее совпадение с действительностью дает распределение электронов по (n + l) группам, предложенное В. М. Клечковским: «В атоме каждый электрон занимает тот подуровень, на котором его энергия будет минимальной».
Выше указывалось, что энергия электрона определяется не только значением главного квантового числа, но и значением орбитального, поэтому для того, чтобы определить, какой подуровень будет заполняться электронами в первую очередь, необходимо учитывать значения обоих квантовых чисел.
Для практического применения правило Клечковского можно сформулировать так:
а) «Заполнение подуровней электронами происходит в последовательности увеличения суммы соответствующих им значений главного и орбитального квантовых чисел».
б) «В случае одинаковых значений этой суммы для нескольких подуровней, заполняется сначала тот подуровень, для которого главное квантовое число имеет наименьшее значение».
Рассмотрим конкретное применение этого правила:
Таблица 13Сумма значений главного и побочного квантового числа
| n | |||||||||||||||||||||
| l | |||||||||||||||||||||
| n + l |
Для первых двух значений сумм (n + l), равных соответственно 1 и 2, нет альтернативных вариантов, и заполнение подуровней происходит в следующей последовательности: 1s и затем 2s. Начиная со значения суммы, равной 3, возникают два варианта: заполнять 2p-подуровень или 3s-подуровень. В соответствии с правилом Клечковского, выбираем тот подуровень, для которого n имеет меньшее значение, т. е. 2p-подуровень. Затем заполняется 3s-подуровень. Далее значение n + l = 4. Таких значений опять два: для 3p-подуровня и для 4s-подуровня (случай, аналогичный предыдущему). Сначала будет заполняться 3p-, а затем 4s-подуровень. 3d-подуровень остается свободным, так как сумма n + l для него больше, чем для 4s.
Применяя правило Клечковского, получим следующую последовательность заполнения энергетических подуровней:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 6p.
Но такое заполнение происходит до определенного момента. Если рассмотреть изменение энергии подуровней с увеличением заряда ядра атома (см. рис. 8), то можно увидеть, что энергия всех подуровней снижается. Но скорость понижения энергии у разных подуровней не одинакова. Поэтому, если до кальция 3d-подуровень был по энергии выше 4s, то начиная со скандия и последующих элементов, его энергия резко снижается, о чем говорит, например, электронное строение иона Fe2+ (1s22s22p63s23p63d6). Из приведенного электронного строения иона видно, что два валентных электрона железа ушли с менее энергетически выгодного 4s-подуровня. Аналогичная инверсия энергий наблюдается у 5s- и 4f-, а также у 6s- и 5f-подуровней.
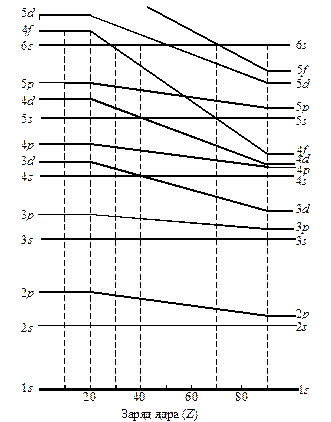
Рис. 6. Схема изменения энергии подуровней с ростом заряда ядра.
В дальнейшем было установлено, что полностью и наполовину заполненные подуровни обладают повышенной устойчивостью. Так, для d-подуровня устойчивыми электронными конфигурациями являются d 10 и d 5, а для f-подуровня – соответственно f 14 и f 7. Этим объясняются аномалии в строении внешних энергетических уровней некоторых элементов, например, у хрома валентные электроны должны были располагаться 3d 44s2, а реально – 3d 54s1, у меди должно быть 3d 94s2, а на самом деле 3d 104s1. Аналогичные переходы электронов с s-подуровня на d-подуровень наблюдаются у молибдена, серебра, золота, а также и у f-элементов.
Есть также и некоторые другие аномалии в строении внешних энергетических уровней, в основном у актиноидов, которые здесь рассматриваться не будут.
После прочтения главы 2
Вы должны знать, что…
Состояние электрона в атоме определяется набором значений четырех квантовых чисел, каждое из которых отражает определенную физическую величину. Для первых трех квантовых чисел можно ввести и геометрическую интерпретацию:
главное квантовое число n определяет размеры орбиталей,
орбитальное квантовое число l определяет геометрическую форму орбиталей,
магнитное квантовое число ml определяет расположение орбиталей в пространстве относительно выбранной системы координат.
Заполнение энергетических подуровней атомов электронами в невозбужденном состоянии подчиняется трем правилам:
принципу Паули,
правилу Хунда и
правилу Клечковского.
Задачи с разбором
1. Могут ли электроны иона Rb+ находиться на следующих орбиталях: 1) 4р; 2) 3f; 3) 5s; 4) 5p?
Решение. Элемент Rb находится в главной подгруппе I группы V периода таблицы Менделеева, значит, у него начинает заполняться электронный уровень с главным квантовым числом n = 5: 5s1. У иона Rb+ внешний электрон потерян. Значит, ни на 5р, ни на 5s-орбиталях невозбужденного иона Rb+ электронов нет. Однако электроны могут переходить на эти орбитали при возбуждении атома.
Изобразим предпоследний уровень (n = 4): 4s2p6d 0f 0. На нем находится 8 электронов, как и у любого s-элемента (т. е. элемента главной подгруппы I или II группы Периодической таблицы, у которого заполняется s-подуровень). Почему 4d и 4f-подуровни пустые? Дело в том, что энергия 4d-подуровня выше, чем 5s, а 4f – даже выше, чем 6s, а сначала заполняются подуровни с меньшей энергией (правило Клечковского). Итак, электроны Rb+ могут находиться на 4р-орбиталях.
Осталось понять, могут ли они находиться на 3f-орбиталях. При n = 3 орбитальное квантовое число l принимает значения 0,1,2, которые соответствуют s, p и d-подуровням. А 3f-подуровня попросту не существует.
2. Приведите примеры трех частиц (атомы, ионы) с электронной конфигурацией 1s22s2p63s2p6.
Решение. Подходящий элемент Периодической системы – Ar (8 электронов на третьем – внешнем – электронном уровне). Ясно, что других атомов с такой электронной конфигурацией нет. Но мы знаем, что элементы, у которых не хватает, как правило, 1 – 3 электронов до устойчивой 8-электронной оболочки, стремятся приобрести их и стать отрицательными ионами, а имеющие 1 – 3 электрона на следующем уровне – отдать их и стать положительными ионами. Таким образом, это могут быть Cl–, S2–, P3–, K+, Ca2+, Sc3+... Выберите любые три частицы на ваш вкус.
3. Сколько элементов было бы в V периоде, если бы спиновое квантовое число имело единственное значение – 1?
Решение. В реальности спиновое квантовое число, как известно, принимает два разных значения: + 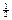 и –
и – 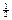 . Если же оно имело бы единственное значение, то электронная оболочка могла бы вместить вдвое меньшее число электронов, т. к. все они должны отличаться друг от друга набором квантовых чисел (принцип Паули), а, следовательно, элементов в периоде было бы в 2 раза меньше.
. Если же оно имело бы единственное значение, то электронная оболочка могла бы вместить вдвое меньшее число электронов, т. к. все они должны отличаться друг от друга набором квантовых чисел (принцип Паули), а, следовательно, элементов в периоде было бы в 2 раза меньше.
4. Какие квантовые числа и как должны, по вашему мнению, измениться при переходе от нашего мира к 1) одномерному; 2) пятимерному?
Решение. Для ответа на этот вопрос необходимо уяснить, какие из 4 квантовых чисел имеют отношение к размерности пространства.
Главное квантовое число n определяет число электронных уровней (оболочек, слоев) и характеризует в основном размер электронного облака:
n = 1 ¢ n = 2 ¢ n = 3 ¢
Понятно, что размерность пространства (ненулевая) не влияет на эту характеристику.
Орбитальное квантовое число l характеризует форму электронного облака. Кроме трехмерного, мы можем наглядно представить себе лишь двух- и одномерный миры. В двухмерном мире электронные облака, как и все остальное, станут плоскими, но понятие формы сохранится. В сущности, изображение объемных электронных облаков на бумаге, проецирование их в плоскость листа, и есть в какой-то мере переход к двухмерному миру. Что же касается одномерного, то здесь понятие формы стирается, остается лишь размер (протяженность). Вероятно, орбитальное квантовое число при этом потеряет смысл.
Если рассматривать пространство большей размерности, чем наше, то понятие «формы» здесь становится гораздо шире, и нельзя исключать, что для описания всего многообразия форм электронных облаков при данном n потребуется больше различных значений l.
Магнитное квантовое число ml характеризует пространственную ориентацию электронного облака, а значит, зависит от размерности напрямую. При l = 0 ml может принимать единственное значение 0, что отражает единственную возможность ориентации в пространстве сферически симметричного s-облака. При l = 1 ml принимает 3 различных значения: – 1, 0, 1 – гантелеобразные p-облака могут быть вытянуты вдоль разных координатных осей: px, py, pz. Если размерность пространства, т. е. число координатных осей, меняется, то изменится и число возможностей для расположения электронных облаков, а значит, набор ml будет другим. Поскольку же количество разных значений ml при данном l определяет количество орбиталей на данном подуровне, это приводит к существенным изменениям в химии.
ms – спиновое квантовое число – принимает два значения: +½ и -½. Это отражает тот факт, что на орбитали может находиться два «противоположно закрученных» электрона. Обычно спин связывается с собственным моментом импульса электрона и, как таковой, может изменяться при переходе к иной размерности пространства.
Задачи для решения
1. Найдите в Периодической системе как можно больше случаев нарушения Периодического закона в формулировке Д. И. Менделеева: «химические и физические свойства элементов находятся в периодической зависимости от их атомных весов». Чем объяснить эти нарушения?
2. Могут ли электроны а) невозбужденного, б) возбужденного иона Na+ находиться на 2s, 2d, 3f, 4s, 5d-орбиталях? Обоснуйте.
3. Напишите электронное строение атомов элементов I и II периодов Периодической системы.
4. Приведите два примера сложных веществ, в состав которых входят только частицы с электронным строением 1s22s2p6.
5. Какие значения имеют квантовые числа для самого внешнего электрона невозбужденного атома лития?
6. Допустим, что некая вселенная Y имеет набор квантовых чисел:
| n = 1, 2, 3, ... | ml = –l, ..., +l |
| l = 0, 1, 2, ..., n | ms = ± 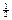 . .
|
Сколько элементов было бы в III периоде периодической системы вселенной Y?
Как вы думаете, сколько измерений может быть во Вселенной Y?
7. Как изменилось бы число элементов во втором периоде нашей периодической системы, если бы при прочих неизменных квантовых числах спин имел бы значения ms = ± 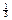 ?
?
8. Сколько протонов и нейтронов содержится в ядрах атомов а) 7Li; б) 119Sn; в) 235U?
Глава III
Химическая связь
Заголовок
Молекулы химических веществ представляют собой сложную систему атомных ядер и электронов. Атомы в молекуле удерживаются преимущественно силами электростатического характера. В этом случае говорят, что они связаны химической связью. Химическая связь осуществляется s- и p-электронами внешнего и d-электронами предвнешнего слоя. Эта связь характеризуется следующими параметрами:
1. Длиной связи – межъядерным расстоянием между двумя химически связанными атомами.
2. Валентным углом – углом между воображаемыми линиями, проходящими через центры химически связанных атомов.
3. Энергией связи – количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии.
4. Кратностью связи – числом электронных пар, посредством которых осуществляется химическая связь между атомами.
Атом в молекуле – понятие условное, т. к. его энергетическое и электронное состояние в корне отличается от изолированного атома, строение которого было разобрано в предыдущей главе. Рассмотрим, какие силы возникают между частицами в простейшей системе, состоящей из двух протонов и одного электрона (см. рис. 9). Если мы будем сближать два протона, то между ними возникнут силы отталкивания, и о получении устойчивой системы говорить не приходится. Поместим в их поле один электрон. Здесь могут возникнуть два случая.
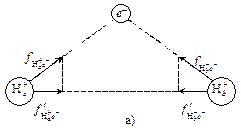

Рис. 9. Распределение сил взаимодействия между ядрами и электроном в  .
.
Первый, когда электрон находится между протонами (а), и второй, когда он располагается за одним из них (б). В обоих случаях возникают силы притяжения. В первом случае составляющие этих сил (проекции) на ось, проходящую через центры протонов, направлены в противоположные стороны с силами отталкивания (см. рис. 9а) и могут их компенсировать. При этом возникает энергетически устойчивая система. Во втором случае составляющие сил притяжения направлены в разные стороны (см. рис. 9б) и трудно говорить об уравновешивании сил отталкивания между протонами. Отсюда следует, что для возникновения химической связи с образованием молекулы или иона электроны должны находиться преимущественно в межъядерном пространстве. Эта область называется связывающей, т. к. при нахождении там электронов образуется химическая связь. Область, находящаяся за ядрами, называется разрыхляющей, т. к. при попадании в нее электронов химическая связь не образуется. Здесь был рассмотрен простейший случай образования химической связи в ионе  . Применив аналогичные рассуждения к молекуле водорода, можно прийти к выводу, что появление второго электрона в связывающей области еще более стабилизирует систему. Следовательно, для образования устойчивой химической связи необходима, по меньшей мере, одна электронная пара. Спины электронов в этом случае должны быть антипараллельны, т. е. направлены в разные стороны. Образование химической связи должно сопровождаться понижением полной энергии системы.
. Применив аналогичные рассуждения к молекуле водорода, можно прийти к выводу, что появление второго электрона в связывающей области еще более стабилизирует систему. Следовательно, для образования устойчивой химической связи необходима, по меньшей мере, одна электронная пара. Спины электронов в этом случае должны быть антипараллельны, т. е. направлены в разные стороны. Образование химической связи должно сопровождаться понижением полной энергии системы.
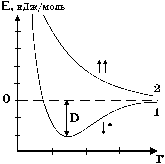
Рис. 10. Изменение потенциальной энергии системы из двух атомов водорода как функции расстояния между ними.
Рассмотрим изменение потенциальной энергии системы на примере сближения двух атомов водорода. Когда атомы находятся на очень большом расстоянии друг от друга, они не взаимодействуют и энергия такой системы близка к нулю. По мере их сближения возникают силы притяжения между электроном одного атома и ядром другого и наоборот. Эти силы увеличиваются обратно пропорционально квадрату расстояния между атомами. Энергия системы понижается. По мере сближения атомов начинают играть роль силы отталкивания между их ядрами и электронами. Увеличение сил отталкивания обратно пропорционально уже шестой степени расстояния. Кривая потенциальной энергии проходит через минимум, а затем резко уходит вверх (рис. 10).
Расстояние, соответствующее положению минимума на кривой, является равновесным межъядерным расстоянием и определяет длину химической связи. Так как атомы в молекуле участвуют в колебательном движении относительно положения равновесия, расстояние между ними постоянно меняется, т. е. атомы не жестко связаны друг с другом. Равновесное расстояние соответствует при данной температуре некоторому усредненному значению. С повышением температуры амплитуда колебания увеличивается. При какой-то достаточно большой температуре атомы могут разлететься на бесконечно большое расстояние друг от друга, что будет соответствовать разрыву химической связи. Глубина минимума по оси энергии определяет энергию химической связи, а величина этой энергии, взятая с обратным знаком, будет равна энергии диссоциации данной двухатомной частицы. Если сближаются атомы водорода, электроны которых имеют параллельные спины, между атомами возникают лишь силы отталкивания, а потенциальная энергия такой системы будет возрастать (рис.10).
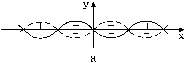
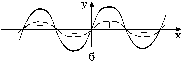
Рис. 11. Результаты сложения двух синусоид.
Как уже отмечалось выше, в образовании химической связи участвуют s-, p- и d-электроны, имеющие различную геометрическую конфигурацию электронных облаков и различные знаки волновых функций в пространстве. Для возникновения химической связи необходимо перекрывание частей электронных оболочек с одинаковым знаком волновой функции. В противном случае химическая связь не образуется. Это утверждение легко объяснить на примере наложения двух синусоид, которые в первом приближении могут отождествляться с волновыми функциями (см. рис. 11):
В случае наложения двух синусоид с разными знаками в одной и той же области (рис. 11а) суммарная составляющая их будет равна нулю – связи нет. В противоположном случае происходит сложение амплитуд колебаний и образуется новая синусоида – химическая связь образовалась (рис. 11б).
В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: s-, p- и d- связи.
s-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. Как видно из рис. 12, в образовании s-связи в силу своей шаровой симметрии всегда принимают участие s-электроны. Они образуют s-связь в результате перекрывания со следующими электронами другого атома: s–, pX–, 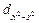 –электронами. С электронами, находящимися на других орбиталях, например, pY или pZ, возникновение химической связи невозможно, так как происходит перекрывание в областях, где электронная плотность имеет противоположные знаки. Возможность образования s-связи s-электронами не исчерпывается, она может образоваться в случае перекрывания и других электронных облаков, таких, как двух pX или pX и
–электронами. С электронами, находящимися на других орбиталях, например, pY или pZ, возникновение химической связи невозможно, так как происходит перекрывание в областях, где электронная плотность имеет противоположные знаки. Возможность образования s-связи s-электронами не исчерпывается, она может образоваться в случае перекрывания и других электронных облаков, таких, как двух pX или pX и 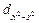 .
.


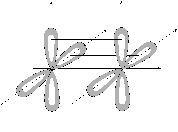
Рис. 13. Примеры p- и d-связей.
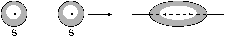

Рис. 12. Некоторые примеры образования s-связей.
p-связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае s-связи. В силу своего пространственного расположения p-связь образуют электроны на таких парах орбиталей как pY – pY, pZ – pZ, pY – dXY.
d-связь образуют только d-электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях. Такое возможно, когда в образовании связи участвуют dXY – dXY, dXZ – dXZ, dYZ – dYZ-электроны.
Выше была рассмотрена классификация химических связей, исходившая из симметрии электронных облаков. Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т. е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. Возможны три случая. Первый: электронная пара связывает в молекуле два одинаковых атома. В этом случае она в равной мере принадлежит им обоим. В молекуле нет разделения центров тяжести положительного и отрицательного зарядов. Они совпадают, и такая связь называется ковалентной неполярной. Если же электронная пара связывает два различных атома, то она смещается в сторону более электроотрицательного атома. Центры тяжести положительного и отрицательного зарядов разделяются, связь становится полярной и носит название ковалентной полярной связи.
Третий случай связан с полной передачей электронной пары во владение одного из атомов. Это происходит при взаимодействии двух атомов, резко отличающихся по электроотрицательности, т. е. способности удерживать электронную пару в своем электрическом поле. При этом атом, отдавший электроны, становится положительно заряженным ионом, а атом, принявший их, – отрицательным. В этом случае связь носит название ионной.
Характер связи во многом определяет физико-химические свойства веществ.
Вещества, молекулы которых характеризуются ковалентной неполярной связью, могут в твердом состоянии образовывать молекулярные и атомные кристаллические решетки. В молекулярных решетках наблюдается очень слабое межмолекулярное взаимодействие. В узлах кристаллической решетки молекулы удерживаются за счет образования в них мгновенных и наведенных диполей. Разделение центров тяжести отрицательных и положительных зарядов в молекуле происходит вследствие вращения пары электронов и расположения ее в какой-то момент времени за одним из ядер. Такое состояние в молекуле наблюдается очень малое время. Поэтому такой диполь носит название мгновенного. Однако этого времени бывает достаточно для того, чтобы индуцировать диполь на другой молекуле. Силы, связывающие молекулы за счет образования мгновенных и наведенных диполей, часто называют ван-дер-ваальсовыми. В общем случае к ван-дер-ваальсовым силам относят любые силы межмолекулярного взаимодействия: диполь-дипольного, ориентационного, дисперсионного и т. п. Ван-дер-ваальсовы силы являются очень слабыми, вследствие чего кристаллическую решетку легко разрушить незначительным нагреванием. Все вещества, имеющие молекулярные кристаллические решетки, обладают низкими температурами плавления и кипения. Ван-дер-ваальсова сила растет с увеличением количества электронов в молекуле, так как повышается вероятность образования мгновенных диполей. В молекуле водорода присутствует одна пара электронов, поэтому он и является самым низкокипящим. Молекулы кислорода и азота отличаются содержанием электронов на одну пару. Их температуры кипения отличаются на 13°C.
Простые вещества, обладающие атомной кристаллической решеткой, наоборот, характеризуются очень высокими температурами плавления и кипения. В этом случае бесконечное число атомов соединено неполярными ковалентными связями в гигантскую молекулу. Энергия разрыва ковалентной неполярной связи велика. Поэтому, чтобы разрушить такую кристаллическую решетку, требуются большие энергетические затраты. В то же время, если вещество характеризуется одним межатомным расстоянием в кристаллической решетке, оно будет обладать и очень высокой твердостью. Примером может служить алмаз.
Температуры плавления и кипения веществ, атомы в молекуле которых связаны ковалентной полярной связью, и обладающие молекулярной решеткой, также низки, но выше чем у веществ с неполярными молекулами. В большинстве своем это газы при комнатной температуре. Примером может служить хлористый водород, сероводород и т. п. Прямой зависимости между величиной дипольного момента и температурой кипения не наблюдается. Скорее всего, она определяется молекулярной массой соединения, за исключением аммиака, воды и фтористого водорода. Эти соединения в ряду им подобных обладают наивысшими температурами плавления и кипения, резкое их увеличение объясняется образованием между молекулами водородных связей.
Атомы азота, кислорода и фтора являются самыми электроотрицательными атомами. Они сильно смещают электронную плотность в молекуле на себя. В результате этого у водорода образуется практически свободная орбиталь, а, например, у атома фтора имеется свободная электронная пара. Появляется возможность образовывать между молекулами дополнительные связи по донорно-акцепторному механизму, что приводит к существованию не только в жидкой, но и газовой фазе молекул состава (HF)n и (H2O)n. Наличие таких молекул приводит к повышению температур кипения и плавления по сравнению с теми же величинами у аналогов.
Наибольшими температурами плавления и кипения обладают вещества, в узлах кристаллической решетки которых расположены ионы. Это объясняется сильным электростатическим взаимодействием положительных и отрицательных ионов. Силы же отталкивания одноименных ионов значительно меньше, т. к. расположены на больших расстояниях друг от друга. Вследствие этого все вещества, имеющие ионные кристаллические решетки, обладают высокими значениями ее энергий образования. Ионная связь осуществляется в галогенидах, оксидах и в солях типа нитратов, сульфатов и т. п. Для разрушения ионных кристаллов требуется значительная тепловая энергия, что и определяет высокие температуры плавления и кипения, которые, в свою очередь, будут зависеть от заряда ионов, их радиусов и электронной подкладки. Чем выше заряд и меньше радиус иона, тем выше температура плавления. Другим свойством ионных веществ является способность образовывать расплавы, хорошо проводящие электрический ток.
Таким образом, можно сделать вывод, что физико-химические свойства соединений сильно зависят от природы химической связи в них.
Электронная пара, образующая химическую связь, как уже отмечалось, находится в общем пользовании двух ядер. В этом случае движение каждого электрона будет описываться новой волновой функцией, являющейся решением уравнения Шредингера для этой системы. Эта волновая функция отличается от атомных функций и называется молекулярной функцией, соответствующей определенной молекулярной орбитали. Молекулярные орбитали характеризуются определенными значениями полной энергии системы. В молекуле, как и в атоме, существует последовательность энергетических уровней. Однако строгое решение уравнения Шредингера для них получить не представляется возможным и поэтому прибегают к приближенным методам расчета, отличающимся друг от друга способом задания молекулярной волновой функции. Наиболее широкое распространение получили два метода: метод валентных связей и метод молекулярных орбиталей.
Дата добавления: 2016-02-13; просмотров: 2506;
