Количественные соотношения в химии
Массы атомов и молекул очень малы, и использовать для численного выражения их величин общепринятую единицу измерения – килограмм – неудобно. Поэтому для выражения масс атомов и молекул используют другую единицу измерения – атомную единицу массы (а. е. м.).
Атомная единица массы(а. е. м.) – единица измерения масс атомов, молекул и элементарных частиц.
За атомную единицу массы принята 1 / 12 массы нуклида углерода 12C. Масса этого нуклида в единицах СИ равна 1,9927 × 10–26 кг.
1 а. е. м. =  mc =
mc =  = 1,6606 × 10–27 кг.
= 1,6606 × 10–27 кг.
Относительная атомная масса (устаревший термин – атомный вес) – масса атома, выраженная в атомных единицах массы (а. е. м.). Обозначается Ar .
Большинство природных химических элементов представляют собой смесь изотопов. Поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе.
Например, кислород имеет три изотопа 16O, 17O и 18O, их атомные массы и содержание в природной смеси приведены в таблице 3.
Таблица 3Изотопный состав кислорода в природной смеси
| Изотоп | Содержание в природной смеси, атомн. % ni | Атомная масса изотопа а. е. м. Ar,i |
| 16O | 99,759 | 15,995 |
| 17O | 0,037 | 16,999 |
| 18O | 0,204 | 17,999 |
Среднее значение атомной массы с учетом вклада каждого изотопа вычисляется по следующей формуле:
Ar = 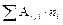 ,
,
где Ar, j – атомные массы соответствующих изотопов, ni – содержание их в природной смеси (в мольных долях). Подставляя в эту формулу соответствующие значения из таблицы 3 для атомной массы кислорода, получим:
Ar = 15,995 × 0,99759 + 16,999 × 0,00037 + 17,999 × 0,0024 =
= 15,999 а. е. м.
Обратите внимание на то, что атомная масса и массовое число – совершенно различные понятия: первое – масса атома, выраженная в а. е. м., а второе – число нуклонов в ядре. Атомная масса – дробная величина (имеет целое значение только для изотопа 12C), в отличие от массового числа, которое является всегда целым.
Численно эти величины очень близки; например, для водорода атомная масса равна 1,0078, а массовое число равно 1, для гелия атомная масса равна 4,0026, а массовое число – 4.
Относительные атомные массы имеют дробные значения по следующим причинам:
1) большинство элементов, существующих в природе, представляют смесь нескольких изотопов, и в Периодической системе указывается среднее значение относительной атомной массы смеси природного изотопного состава.
2) для моноизотопных элементов (например, 23Na) это значение будет также дробным, т. к. масса нуклонов, выраженная в а. е. м., не является целым числом (см. табл. 3) и при образовании ядра часть массы нуклонов переходит в энергию, в соответствии с уравнением Eсвязи = Dm × c2, где c = 3 × 108 м/с – скорость света в вакууме.
При образовании любой связи всегда выделяется энергия, на что и расходуется часть массы связывающихся частиц. В случае образования химических связей эта величина очень мала, поэтому изменением массы здесь пренебрегают и считают, что масса образовавшейся частицы равна сумме масс частиц, участвующих в ее образовании. При образовании же ядра выделяется очень большая энергия, и «дефект массы» хорошо заметен.
Молекулярная масса – масса молекулы, выраженная в а. е. м. Масса молекулы практически равна сумме относительных атомных масс входящих в нее атомов.
Если же вещество состоит не из молекул, а, например, из ионов (NaCl), или является олигомером [(H2O)n], то относительную молекулярную массу указывают для формульной единицы вещества. Под формульной единицей вещества следует понимать химический состав наименьшего количества данного вещества.
Моль – единица измерения количества вещества. Обозначается n. 1 моль – это такое количество вещества, в котором содержится столько же структурных единиц (атомов, молекул, ионов, радикалов), сколько атомов содержится в 0,012 кг изотопа углерода 12C, а именно –
NA = 6,022 × 1023 моль–1 – число Авогадро.
Молярная масса вещества (М) равна отношению массы этого вещества (m) к его количеству (n):
M =  .
.
Прежнее определение: масса одного моля вещества, численно равна его молекулярной массе, но выражается в единицах г/моль. Возможно, оно, на первых порах, облегчит решение расчетных задач.
Обратите внимание на различие в понятиях: «молярная масса» и «молекулярная масса», похожих по звучанию, но относящихся к разному числу объектов: первое – это масса одного моля вещества (т. е. масса 6,022 × 1023 молекул), а второе – масса одной молекулы, и выражены они в разных единицах – г/моль и а. е. м. соответственно.
Понятие «количество вещества» и, соответственно, единица его измерения – моль используются в большинстве химических расчетов. Эта величина однозначно связана с массой, числом структурных единиц и объемом (если это газ или пары) вещества. Если задано количество вещества, то эти величины легко рассчитать.
| N = n × NA | m = n × M | |||
| õø | ÷ö | |||
| n | ||||
| ô | ||||
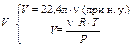
|
Массовая доля вещества A в системе – отношение его массы к массе всей системы (часто эту величину выражают в %):
wA = 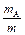 ´ 100%
´ 100%
Все задачи, связанные с расчетами по массовым долям, следует решать, используя эту формулу. Чтобы избежать досадных технических ошибок, рекомендуем при проведении расчетов сразу же % перевести в доли.
Объемная доля компонента – отношение объема компонента к объему всей системы:
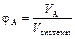
Мольная доля компонента – отношение количества вещества (моль) компонента A к общему количеству молей всех компонентов системы:
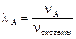
Закон сохранения энергии – энергия не возникает из ничего и не исчезает бесследно, но отдельные ее виды могут переходить друг в друга по строго определенным эквивалентным соотношениям.
Так, если энергия химических связей в продуктах реакции больше, чем в реагентах, то освобожденная энергия выделяется в виде тепла, света, либо за счет нее произойдет работа (например, взрыв или движение поршня).
Закон сохранения массы (М. В. Ломоносов, 1748 г.) – масса всех веществ, вступивших в реакцию, равна массе всех продуктов реакции.
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется.
На основании этого закона проводятся все расчеты по уравнениям химических реакций.
Закон постоянства состава (Пруст, 1806 г.) – каждое химическое соединение имеет вполне определенный и постоянный состав.
Как следствие из этого закона вытекает, что состав химического соединения не зависит от способа его получения.
Вещества, состав которых подчиняется этому закону, получили название дальтониды. Вещества, состав которых зависит от способа получения, называются бертоллидами (например, оксиды переходных металлов).
Закон кратных отношений (Дальтон) – если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого, относятся между собой как небольшие целые числа.
Закон Авогадро (1811 г.) – в равных объемах различных идеальных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Дата добавления: 2016-02-13; просмотров: 1757;
