Химические символы и формулы
В химии, как и в каждой науке, есть своя система условных знаков, знание которой необходимо для понимания этого предмета.
Химическая символика – это своеобразный алфавит, с помощью которого записывают «слова» – формулы соединений и «фразы» – уравнения химических реакций, в той или иной мере отражающие реально происходящие процессы.
Еще в средневековье известные тогда химические элементы обозначали условными символами, такими же, какие использовали для обозначения небесных тел. Дело в том, что, по представлениям алхимиков, каждому из известных в то время элементов соответствовало свое небесное тело.
Некоторые представления алхимиков отражены в стихотворной форме:
Семь металлов создал свет –
По числу семи планет.
Дал нам космос на добро:
Медь, железо, серебро,
Злато, олово, свинец,
Сын мой, сера – их отец.
И спеши, мой сын, узнать:
Всем им ртуть – родная мать.
Обозначения небесных тел и «соответствующих» им химических элементов, принятые в средние века, представлены в таблице 4.
Таблица 4Символы химических элементов, принятые в средние века
| Элемент | Золото | Серебро | Железо | Медь | Ртуть | Свинец | Олово |
| Небесное тело | Солнце | Луна | Марс | Венера | Меркурий | Сатурн | Юпитер |
| Символ | 
| 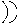
| 
| 
| 
| 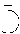
| 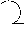
|
Безусловно, такие символы для обозначения химических элементов были не очень удобны. Более того, к 1800 году было известно около 34 химических элементов (правда, некоторые еще не были выделены как простые вещества, а были известны преимущественно в виде оксидов), и использование подобной символики стало невозможным.
Д. Дальтон предложил другие обозначения химических элементов, ниже приведены некоторые примеры этой символики:
Таблица 5Символы химических элементов, предложенные Д. Дальтоном
| Водород | Азот | Углерод | Кислород | Сера | Фосфор | Железо | Медь | Свинец |

| 
| 
| 
| 
| 
| 
| 
| 
|
Как видно из этих примеров, в некоторых случаях Дальтон использовал начальные буквы английских названий элементов (например: железо – Iron, медь – Copper, свинец – Lead), обведенные кружком. Известный шведский химик XIX столетия Йенс Якоб Берцелиус, внесший большой вклад в разработку атомистической теории Дальтона, предложил совершенно новую символику для обозначения химических элементов. Он решил, что каждому химическому элементу должен соответствовать свой особый знак, который одновременно был бы и символом химического элемента и обозначал бы один атом. В качестве такого символа было предложено использовать начальную букву латинского названия элемента (например, водород – Hidrohenium – символ H, сера – Sulfur – S и т. п.). В тех случаях, когда названия двух элементов начинаются с одной и той же буквы, добавлялась вторая буква, входящая в название этого элемента, например, C – углерод, Cu – медь, Cd – кадмий. Так появились символы химических элементов, которыми пользуются во всем мире и поныне.
Некоторые элементы (например, железо, золото, свинец) известны с глубокой древности, и их названия имеют историческое происхождение.
В основу названий элементов, открытых за последние 300 лет, были положены различные принципы: по минералу, из которого впервые был выделен этот элемент, например, бериллий(по названию минерала – берилла), по названию страны – родины первооткрывателя, например, германий (нем. химик К. Винклер) в честь Германии, по некоторым свойствам, например, хлор (от греч. clwros – зеленый), фосфор (от греч. jws – свет, jerw – несу). Искусственные элементы получили свои названия в честь известных ученых, например, менделевий, эйнштейний.
Если символ химического элемента мысленно вписать в квадрат, то углы этого квадрата используют, при необходимости, для дополнительной информации:
| массовое число изотопа | заряд иона | |
| Э | ||
| Порядковый номер элемента (заряд ядра) | число атомов элемента в соединении |
С помощью химических символов элементов записывают химические формулы веществ. Например, формула серной кислоты H2SO4 показывает, что молекула этого соединения состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода. Используя химические формулы, записывают уравнения химических реакций, например:
C + O2 = CO2
HCl + NaOH = NaCl + H2O
В левую часть уравнения записывают вещества, вступающие в химическую реакцию (исходные вещества), а в правую – вещества, образующиеся в результате реакции (продукты реакции), причем число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части (закон сохранения массы веществ).
Любая химическая формула – это условная запись, которая несет определенную информацию о данном веществе, и в зависимости от того, какую информацию хотят сообщить, пользуются различными формулами.
1°. Молекулярная формула (или брутто-формула) отражает только качественный и количественный состав соединения, т. е. показывает, атомы каких элементов и в каком количестве входят в состав данного вещества, и ничего не говорит о его строении, например:
| H2O | CH4 | C2H4 | NH3 |
| вода | метан | этилен | аммиак |
2°. Графическая формула (ее ошибочно часто называют структурной формулой) дает дополнительную информацию: кроме качественного и количественного состава она показывает, в какой последовательности атомы связаны друг с другом, а также указывает кратности связей (простая, двойная, тройная):
| H‑O‑H | 
| 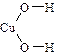
| 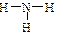
|
Однако эти формулы ничего не говорят о структуре молекул, т. е. не отражают относительное расположение атомов в пространстве.
3°. Электронная формула несет дополнительную информацию по сравнению с графической (хотя, по сути, очень на нее похожа) – показывает, какие из валентных электронов участвуют в образовании связей, а также наличие неспаренных электронов и неподеленных электронных пар:

| 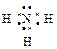
|
4°. Структурная формула изображается в масштабе, в соответствующей проекции, дающей объемное представление о молекуле и показывает относительное расположение атомов в пространстве. При необходимости к структурным формулам прилагаются таблицы, в которых указывают длины связей (расстояния между центрами связанных атомов) и валентные углы (углы между связями).
5°. Возможно использование и других вариантов формул для передачи соответствующей информации о молекуле или облегчающих восприятие информации, например

| 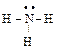
| ÿ BF3 |
ÿ показывает наличие свободной орбитали
Задачи с разбором
1. Сколько атомов водорода содержится в 1 л водорода при н. у.?
Решение. Т. к. 1 моль любого идеального газа занимает при н. у. 22,4 л, то в 1 л водорода (мы можем считать его приближенно идеальным газом) будет содержаться  = 0,045 моль молекул водорода. Каждая молекула водорода состоит из двух атомов, значит, количество атомов в два раза больше: 2 × 0,045 = 0,09 моль. Чтобы найти, сколько атомов находится в этом количестве вещества, умножим его на число Авогадро:
= 0,045 моль молекул водорода. Каждая молекула водорода состоит из двух атомов, значит, количество атомов в два раза больше: 2 × 0,045 = 0,09 моль. Чтобы найти, сколько атомов находится в этом количестве вещества, умножим его на число Авогадро:
0,09 × 6,022 × 1023 = 5,4 × 1022 штук.
2. Какова масса 1 молекулы NaOH?
Решение. Рассчитаем сначала молекулярную массу NaOH в единицах а. е. м., исходя из значений атомных масс натрия, кислорода и водорода.
Mr(NaOH) = 23 + 16 + 1 = 40 а. е. м.
А теперь переведем в единицы СИ:
40 × 1,6606 × 10–27 = 6,64 × 10–26 кг.
3. Какая энергия выделяется при образовании атома гелия из элементарных частиц?
Решение. Атомная масса гелия 4,0026 а. е. м. Рассчитаем суммарную массу элементарных частиц, составляющих гелий:
2mp + 2mn + 2me = 2(1,007 + 1,009 + 5,5 × 10–4) = 4,0331 а. е. м.
Дефект массы составляет
4,0331 – 4,0026 = 3,05 × 10–2 а. е. м.
или
3,05 × 10–2 × 1,6606 × 10–27 = 5,1 × 10–29 кг.
Е = Dmc2 = 5,1 × 10–29 × (3 × 108)2 = 4,6 × 10–13 Дж.
4. А г СаО растворили в избытке воды массой В г. Выразите массовую долю вещества в полученном растворе.
Решение. Для решения этой задачи необходимо помнить, что при растворении оксида кальция в воде происходит реакция СаО + Н2О = Са(ОН)2, поэтому растворенным веществом будет гидроксид кальция.
w =  (´ 100%).
(´ 100%).
Массу вещества найдем по уравнению реакции:
m(Са(ОН)2) = М(Са(ОН)2) × 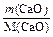 = 74 ×
= 74 ×  = 1,32А.
= 1,32А.
Масса раствора складывается из массы веществ, образовавших этот раствор (поскольку в результате реакции не выпадает осадок и не выделяется газ, ничего вычитать не требуется) A + B. Таким образом, w = 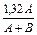 (´ 100%).
(´ 100%).
5. Смешали 11,2 л хлора и 22,4 л водорода. Найдите объемные доли газов в смеси после прохождения реакции.
Решение. Протекает реакция H2 + Cl2 = 2 HCl. Так как объемы газов пропорциональны их количествам веществ, то 1 объем водорода будет реагировать с 1 объемом хлора, при этом образуются 2 объема хлороводорода. Хлор в недостатке, он прореагирует полностью; 11,2 л водорода вступит в реакцию и еще 11,2 л останется. Хлороводорода получится 2 × 11,2 = 22,4 л.
Суммарный объем системы 11,2 + 22,4 = 33,6 л. Объемная доля водорода 11,2 / 33,6 = 0,33 (33%), хлороводорода 22,4 / 33,6 = 0,67 (67%), или
100 – 33 = 67%.
6. В сплаве содержится 40 % K и 60 % Na. Найдите мольные доли компонентов.
Решение. М(K) = 39, M(Na) = 23. Если в 100 г сплава содержится 40 г K, то это составляет 40 / 39 = 1,03 моль. 60 г натрия – это 60 / 23 = 2,61 моль. Общее количество вещества в 100 г сплава 1,03 + 2,61 = 3,64 моль. Отсюда мольные доли: калия 1,03 / 3,64 = 0,28 (28%), натрия 2,61 / 3,64 = 0,72 (72%), или 100 – 28 = 72%.
7. Соединение углерода с водородом содержит 75 % углерода по массе. Найдите формулу этого соединения.
Решение. Напишем формулу в общем виде: СхНу . Масса углерода в молекуле этого вещества пропорциональна 12х, водорода – у. Т. к. массовая доля углерода 75%, получаем: 12х : у = 75 : 25, отсюда х : у = 6,25 : 25 = 1 : 4. Искомая формула СН4.
8. Плотность газа по воздуху 0,55. Что это за газ?
Решение. Средняя молярная масса воздуха 29. Чтобы найти молярную массу газа, умножим 29 на плотность газа: 29 × 0,55 = 16. Эта молярная масса соответствует метану СН4, других вариантов нет.
Задачи для решения
1. Суммарный заряд какого количества электронов составляет 1 Кл? Какова масса 1 моль электронов?
2. Сколько атомов водорода содержится в 3 л воды а) при 20°С и 1 атм; б) при 150°С и 1 атм?
3. Какая энергия выделится при образовании из элементарных частиц 1 моль нуклидов 16О?
4. В избытке воды объемом 1 лрастворили х г калия. Какова массовая доля вещества в полученном растворе?
5. 16,8 л хлороводорода и 5,6 л бромоводорода растворили в 100 мл воды. Найдите массовые доли веществ в растворе.
6. При 2000°С степень термической диссоциации (т. е. мольная доля молекул, распавшихся под действием тепла) воды составляет около 2%. Рассчитайте мольные и объемные доли всех компонентов в равновесной смеси при этой температуре.
7. Рассчитайте массовую долю спирта в водном растворе с объемной долей 40%, если плотность спирта (при 20°С) 0,79 г/мл.
8. Слили два раствора: 10 г 20% хлорида бария и 20 г 10% сульфата калия. Найдите массовые доли всех растворенных веществ.
9. В соединении азота с водородом содержится 87,5% азота по массе. Найдите формулу этого соединения.
10. Некий газ имеет плотность по водороду 8,5. Что это за газ?
11. Изобразите графические формулы азота, оксида железа (III), фосфорной кислоты.
Глава II
Строение атома
Дата добавления: 2016-02-13; просмотров: 2091;
