Характеристичні функції
Дуже важливими для практики є характеристичні функції, вони дають певні фізичні величини, які можуть бути виміряні на практиці. Всі термодинамічні потенціали при природних умовах є характеристичними функціями. Так їх називають тому, що за величиною самої функції та її похідних можна просто і в явному вигляді представити всі термодинамічні властивості системи. Аналогічно, при v = const і Т = const характеристичною функцією буде вільна енергія Гельмгольца, а при р = const і Т = const – потенціал Гіббса.
Розглянемо деякі термодинамічні співвідношення. Розглянемо вільну енергію Гіббса:
G = H – TS. (2.43)
Диференціюємо
dG = dH – TdS – SdT. (2.44)
З рівняння (2.8)
dG = dU +pdv + vdp – TdS – SdT. (2.45)
З рівняння (2.5)
dG = dq + vdp – TdS – SdT. (2.46)
Оскільки dS = 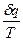
dG = vdp – SdT. (2.47)
Розділемо на dp, при постійній температурі, матимемо
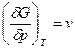 . (2.48)
. (2.48)
Можна отримати і інші співвідношення, наприклад
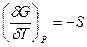 (2.49)
(2.49)
та
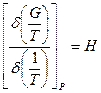 . (2.50)
. (2.50)
Підсумуємо
Функції стану системи – U, H, S, F, G.
U dU = TdS – pdv 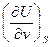 = –р,
= –р, 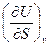 = T
= T
H = U + pv dH = TdS + vdp 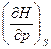 = v,
= v, 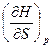 = T
= T
S dS = dU/T = (Cv/T) dT 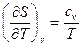
dS = dH/T = (Cp/T) dT 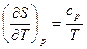
F = U – TS dF = -SdT – pdv 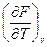 = –S,
= –S, 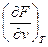 = –p
= –p
G = U – TS + pv = H – TS dG = -SdT + vdp 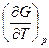 = –S,
= –S, 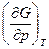 = v
= v
Беручи різні похідні, можна отримувати значення фізичних властивостей, які представляють інтерес для фахівців, що не займаються діаграмами стану.
Наприклад, без виводу, коефіцієнт розширення
a = 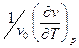
 (2.51)
(2.51)
Коефіцієнт стискуваності
b = 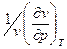 (2.52)
(2.52)
Подібних формул дуже багато. Існують навіть таблиці, з яких можна взяти інформацію, якій властивості дорівнюють які похідні.
Дата добавления: 2016-02-27; просмотров: 707;
