Тепловий ефект реакції.
Всі хімічні та металургійні процеси супроводжуються виділенням або поглинанням тепла – тепловим ефектом. Розділ фізичної хімії, який вивчає теплові ефекти процесів (хімічних або металургійних), називається термохімією. Всі теоретичні висновки термохімії базуються на застосуванні першого закону термодинаміки.
Тепловий ефект реакції – це теплота, яка виділяється або поглинається при протіканні реакції, якщо в системі не здійснюється жодних робіт окрім роботи проти зовнішнього тиску, а продукти реакції мають ту само температуру, що й вихідні речовини.
В термохімії прийнято вважати позитивним тепловий ефект екзотермічних реакцій (коли тепло виділяється) і негативним тепловий ефект ендотермічних реакцій (тепло поглинається). Тоді між термодинамічною теплотою процесу q і термохімічним тепловим ефектом Q існує співвідношення:
Q = -q (2.16)
Теплові ефекти визначають експериментально в калориметрах – приборах, які не мають теплообміну з оточуючим середовищем. По зміні температури після реакції розраховують кількість поглиненого або вивільненого тепла. Видів калориметрії і відповідно типів приладів дуже багато – калориметрія розчинення, згоряння та інш. Не завжди можна точно визначити теплові ефекти. До калориметричних експериментів є багато вимог: щоб реакція проходила досить швидко, до кінця і не була зворотною. Дуже сер’ьозні вимоги до матеріалу тиглів і т.і. Тому дуже важливим стає розрахунок теплових ефектів реакцій.
Теплові ефекти завжди визначають при сталості не тільки температури, а й ще одного з параметрів системи – об’єму або тиску. Частіше тиску бо це легше втілити експериментально. Тоді говорять про тепловий ефект при постійному тиску Qр. Іноді реакцію проводять у герметично замкнутих посудинах – бомбах. Тоді отримують тепловий ефект припостійному об’ємі Qv. Комбінуючи вирази першого закону термодинаміки для випадків постійних об’єму або тиску (рівняння 2.7, 2.8) з рівнянням (2.16) отримуємо
qv = DUv.= -Qv (2.17)
та
qр = DНр.= -Qр (2.18)
Іншими словами можна сказати, що тепловий ефект реакції це зменшення внутрішньої енергії системи при v=const або зменшення ентальпії системи при р=const.
З виразів (2.17, 2.18) видно, що поняття «тепловий ефект реакції» не є синонимом поняття «теплота процесу», адже теплота процесу залежить від шляху реакції, а тепловий ефект від нього не залежить, так само як внутрішня енергія і ентальпія. Це було експериментально встановлено в 1836 році російським хіміком професором Германом Івановичем Гессом і називається законом Гесса, який є головним законом термохімії.
Закон Гесса. Тепловий ефект реакції не залежить від проміжних стадій, а визначається лише початковим і кінцевим станом системи. Закон Гесса є безпосереднім наслідком першого закону термодинаміки і його можна розглядати як ще одне формулування першого закону для випадку, коли v або р – сталі. Його ілюструє рис. 2.3.
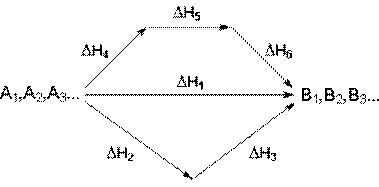
| Рис. 2.3. Ілюстрація закону Гесса. Перехід зі стану А до стану В різними шляхами. |
Згідно з законом Гесса:
DН1 = DН2 + DН3 = DН4 + DН5 + DН6 (2.19)
Термохімічні рівняння і їх використання. Тепловий ефект завжди відносять до 1 г-моль продукту реакції (в технічних розрахунках інколи – до 1 кг або 1 м3 речовини). Наприклад, рівняння
H2 + 1/2O2 = H2O (р) + 286.9 кДж (2.20)
означає, що при утворенні 1 г-моль рідкої води з елементів виділяється 286.9 кДж тепла.
Для розрахунків теплових ефектів реакцій, які виміряти не можна, застосовують закон Гесса. З його формулювання виходить, що з термохімічними рівняннями можна поводитися як з алгебраїчними – додавати, віднімати.
Приклад: Розрахувати тепловий ефект утворення моноксиду Карбону СО:
С + 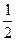 О2 = СО + х (2.21)
О2 = СО + х (2.21)
Використаємо експериментальні дані з теплових ефектів реакцій утворення СО2 з елементів і згоряння СО:
С + О2 = СО2 + Q1 (2.22)
СO + 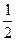 О2 = СО2 + Q2 (2.23)
О2 = СО2 + Q2 (2.23)
Складемо рівняння (2.21) і (2.23):
С + 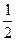 О2 + СO +
О2 + СO + 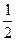 О2 = СО + х + СО2 + Q2 (2.24)
О2 = СО + х + СО2 + Q2 (2.24)
Після скорочення отримуємо:
С + О2 = СО2 + (х + Q2) (2.25)
Порівнюємо з рівнянням (2.22), маємо:
СО2 + Q1 = СО2 + (х + Q2), або Q1 = х + Q2, або х = Q1 - Q2 (2.26)
Такі міркування можна застосовувати для будь-яких реакцій.
Наслідки закону Гесса:
1. Тепловий ефект реакції дорівнює різниці теплот утворення з елементів продуктів реакції і вихідних речовин.
2. Теплота утворення сполуки дорівнює різниці між теплотами згоряння всіх вихідних речовин (з урахуванням стехіометричних коефіцієнтів) і теплотою згоряння даної сполуки.
Стандартний стан. Дуже важливим в термодинаміці є вибір стандартного стану. За стандартні умови домовилися брати стан речовини при тиску 1 бар (~1 атм) і температурі 25 оС. Для рідких і твердих тіл (розплави, сплави) приймається, що вони знаходяться в тому агрегатному стані або модифікації, як при 25 оС і 1 атм. Наприклад, вода – рідка, ртуть – рідка, сірка – тверда в ромбічній модифікації, титан – твердий в a-модифікації. Гази і рідини в стандартному стані вважають ідеальними. Стандартні ентальпії простих речовин прийняті рівними 0. Нестандартні ентальпії не рівні 0. Ентальпії утворення речовин (або теплові ефекти реакцій утворення з протилежним знаком) зведені в таблиці термодинамічних даних у довідниках і базах даних. У нас найбільш повний довідник – «Термічні константи речовин» - 10-ти томне видання. В цих таблицях наведені стандартні ентальпії утворення DfНo. Це ентальпія утворення речовини з елементів, які також перебувають у стандартному стані. Наприклад, DfНo (СО2) = -393.5 кДж/моль. Це означає, що стандартна ентальпія 1 моля СО2 на 393.5 кДж менше, ніж сума стандартних ентальпій 1 моля С і 1 моля О2.
Дата добавления: 2016-02-27; просмотров: 4228;
