Термодинамічні потенціали
Досить часто необхідно знати, чи можливе протікання якої-небудь реакції чи процесу і як вони далеко можуть пройти при заданих вихідних умовах, тобто параметрах системи, як то температура, тиск і концентрації компонентів. Перед цим ми показали, що у рівноважних умовах ентропія системи має бути максимальною. Але цей критерій рівноваги був одержаний нами для ізольованої системи, а на практиці, зокрема у металургії ми маємо, як правило, справу з неізольованими системами. Для розрахунку умов рівноваги в таких системах в термодинаміку введено ряд нових функцій стану, які можуть бути одержані за допомогою першого і другого законів термодинаміки.
Цими функціями є: вільна енергія Гельмгольца для умов v = const, Т = const. Ізохорно-ізотермічний процес F = U – TS. Назва «вільна енергія» використовується тому, що: внутрішню енергію можна представити як U = F + TS, де TS – це частина внутрішньої енергії, яка не може бути перетворена на роботу, або зв’язана енергія, а F – це та частина внутрішньої енергії, яка при ізотермічних умовах може бути повністю перетворена на роботу, отже вільна енергія. Довільними будуть процеси, при яких А 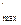 >0, і відтак dF<0, тобто процеси, які йдуть зі зменшенням вільної енергії. Умовою істинної рівноваги буде F = min, dF = 0, d2F>0.
>0, і відтак dF<0, тобто процеси, які йдуть зі зменшенням вільної енергії. Умовою істинної рівноваги буде F = min, dF = 0, d2F>0.
Та вільна енергія Гіббса G = U - TS + рv = Н – TS, або енергія Гіббса, або ізобарно-ізотермічний потенціал, або термодинамічний потенціал Гіббса, або потенціал Гіббса для умов р = const, Т = const. Ізобарно-ізотермічний процес. Це найбільш важливий процес, який найчастіше реалізується на практиці, зокрема в металургії. Довільними будуть процеси, при яких А 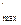 >0, і відтак dG<0, тобто процеси, які йдуть зі зменшенням енергії Гіббса. Умовою істинної рівноваги буде G = min, dG = 0, d2G>0. Іншими словами в усіх природних довільних ізобарно-ізотермічних процесах термодинамічний потенціал Гіббса зменшується і досягає мінімуму при рівновазі. Любе відхилення від рівноваги призводить до збільшення термодинамічного потенціалу Гіббса.(Зазначимо, що у старій вітчизняній літературі ізобарно-ізотермічний потенціал часто позначається літерою Z).
>0, і відтак dG<0, тобто процеси, які йдуть зі зменшенням енергії Гіббса. Умовою істинної рівноваги буде G = min, dG = 0, d2G>0. Іншими словами в усіх природних довільних ізобарно-ізотермічних процесах термодинамічний потенціал Гіббса зменшується і досягає мінімуму при рівновазі. Любе відхилення від рівноваги призводить до збільшення термодинамічного потенціалу Гіббса.(Зазначимо, що у старій вітчизняній літературі ізобарно-ізотермічний потенціал часто позначається літерою Z).
Дата добавления: 2016-02-27; просмотров: 953;
